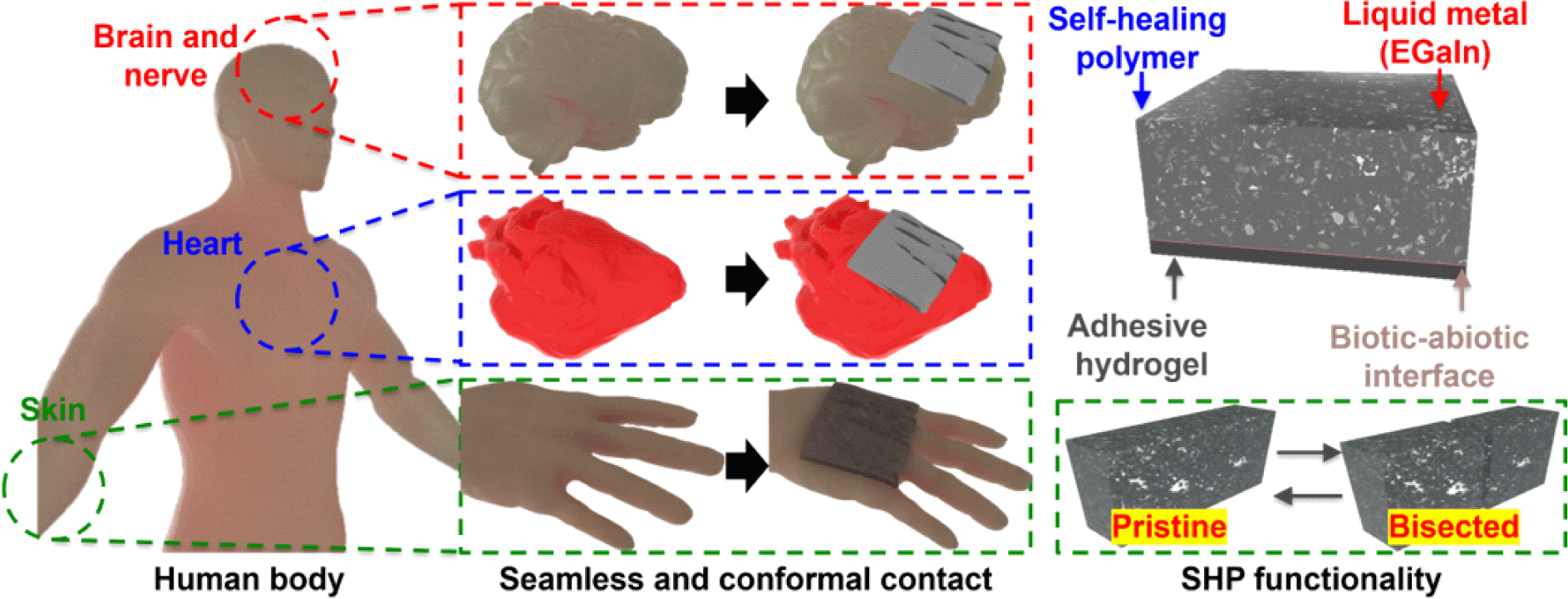
1. 서론
신축성 전자 디바이스는 신경 인터페이스[1,2], 의수 [3-6], 유연 로봇[7-9], 그리고 휴먼-기계 인터페이스[10,11] 등과 같은 착용형/이식형 생체 전자공학 응용 분야 개발에 큰 변혁을 가져오고 있다. 이러한 전자 디바이스는 인간의 피부나 조직에 안정적으로 부착할 수 있도록 신축성이 있는 소자로 개발되어 왔는데, 그 중 단단한 물성을 가지고 있음에도 구조적 접근을 통해 유연성을 가지고자 한 접근법은 대표적으로 오리가미(origami), 키리가미(kirigami), 설펜타인(serpentine), 그리고 아일랜드(rigid-island) 등이 있다. 그러나, 이러한 방법들은 부드러운 생체 조직과 달리 단단한 물성을 가지고 있어 자체적으로 신장 가능하고 유연한 고분자 기반의 전자 디바이스를 개발하는 접근법 또한 제시되고 있다.
이 중 자가치유 고분자(self-healing polymer)는 외부 자극 없이도 손상된 부분을 스스로 복구할 수 있는 능력 덕분에, 디바이스의 장기적 안정성과 반복적인 변형 환경에서의 내구성을 크게 향상시키는 소재로 주목받고 있다[12-16]. 그러나, 자가치유 고분자는 본래 전기적 특성을 가지지 않아 전자소자로의 직접적인 활용이 어려운 한계가 있다. 이를 해결하기 위해 전도성 필러(conducting filler)를 첨가해 전기 전도성을 부여한 고분자 복합체(composite polymer)를 제작하는 방법이 제안되었으며, 이로써 유연하고 부드러운 전자소자로 활용이 기능해졌다. 한편, 전도성 필러는 고분자의 물성에 영향을 미칠 수 있는 단점이 있어, 이를 보완할 수 있는 새로운 전도성 물질이 요구되었다. 이에, 전기적 전도성과 기계적 유연성을 동시에 갖춘 액체 금속이 신축성 전자 디바이스의 전극 및 회로 구성에 핵심 소재로 사용되고 있다[17-19]. 그러나 액체 금속은 미세 패터닝 공정이 까다롭고, 습윤 환경에서 산화가 진행되면 전도성이 급격히 저하되는 한계를 가진다. 이러한 한계를 극복하기 위해, 습윤한 생체 환경에서도 안정적인 전기 전도성을 제공할 수 있는 전도성 하이드로겔이 대안으로 떠오르고 있다. 전도성 하이드로겔은 생체 조직과 유사한 물성을 갖추어 조직 손상을 최소화할 뿐 아니라, 습윤한 환경에서도 강한 접착력을 유지할 수 있다는 점에서 중요한 소재로 평가받고 있다[20-23]. 이러한 특성 덕분에, 전도성 하이드로겔 기반의 접착성 바이오 전자소자는 조직에 안정적으로 부착되어 장기간 기능을 유지할 수 있다. 이에 본 리뷰에서는 신축성 고분자, 액체 금속, 그리고 전도성 하이드로겔의 특성과 이들을 활용한 접착성 바이오 전자소자의 최신 연구 동향을 살펴보고, 다양한 신체 부위에 적용된 응용연구 사례들을 소개하고자 한다.
2. 본론
자가치유 고분자는 기존 고분자처럼 부드럽고 유연할 뿐만 아니라, 긁힘이나 잘림 등의 손상이 발생하더라도 화학적 결합이 파괴된 후 재결합하여 스스로 복구할 수 있는 특성을 가지고 있다. 자가치유 고분자 결합의 종류로는 크게 수소 결합, π-π 상호작용, 금속-리간드 상호작용 등과 같은 초분자(supramolecular) 결합이나 disulfide 결합, Diels-Alder 반응과 같은 동적 공유 결합 등이 있다. 자가치유 고분자는 이러한 결합들이 복합적으로 작용하여 손상이 발생되어도 복구 성능을 발휘할 수 있다[16,24]. 특히, 다양한 비공유 결합에 기반한 초분자 결합은 강하고 역동적인 구조를 형성해 가역적 특성을 가지게 되는데, 이는 부드러운 조직과의 기계적 적응성을 충족하기에 적합하다.
한편, 피부나 생체 조직의 반복적인 연신환경이나 순간적인 기계적 손상에도 소자가 견딜 수 있도록 하기 위해서는 자가치유 고분자를 통해 내구성을 확보하는 것이 필요하다. 그러나 대부분의 자가치유 고분자는 초분자 화학에 기초한 약한 비공유 결합을 기반으로 하기 때문에 역동적인 체내 환경을 버티기에 충분한 기계적 강성을 가지지 못하며 조그마한 손상에도 쉽게 파손될 염려가 있다. 유연한 전자소자는 기계적 변형이 일어났을 때 변형에 따른 응력을 효과적으로 분산시킬 수 있어 소자의 전기적 성능이 유지되는 것을 필요로 한다. 스탠포드 대학교 Zhenan Bao 교수 연구팀은 기존 낮은 강성을 가지고 균열에 취약한 특성을 가진 기존 자가치유 고분자의 한계를 극복하기 위해 강한 수소 결합과 약한 수소 결합이 자발적으로 혼합되어 있어 강한 내구성을 가진 polydimethylsiloxane (PDMS) 기반의 자가치유 고분자를 개발하였다(Fig. 1(a))[12]. 본 polydimethylsiloxane-4,4′-methylenebis (phenylurea)-isophorone bisurea(PDMS-MPU-IU) 고분자는 MPU의 강한 수소 결합에 따라 물질의 탄력성과 견고성을 확보하고, IU의 약한 수소 결합에 따라 효율적으로 동적 결합이 파괴되거나 재형성되어 변형 에너지를 소산시킬 수 있으며, 기계적 물성 목적에 맞게 MPU와 IU 비율을 조절하여 소자를 제작할 수 있다. 약한 수소 결합을 잇는 PDMS 연결고리가 끊어지면서 3,000%까지 인장이 이루어지고, 작은 균열이 생기면 수소 결합이 다시 형성되면서 자가치유가 진행된다. 특히, 수소 결합 기반의 고분자이기 때문에 체내에서 금속이온의 누출이 없을 뿐 아니라, 소수성 특성 덕분에 수분에 민감하지 않아 땀과 같은 체액 환경에서도 회복이 가능함을 보여주었다.
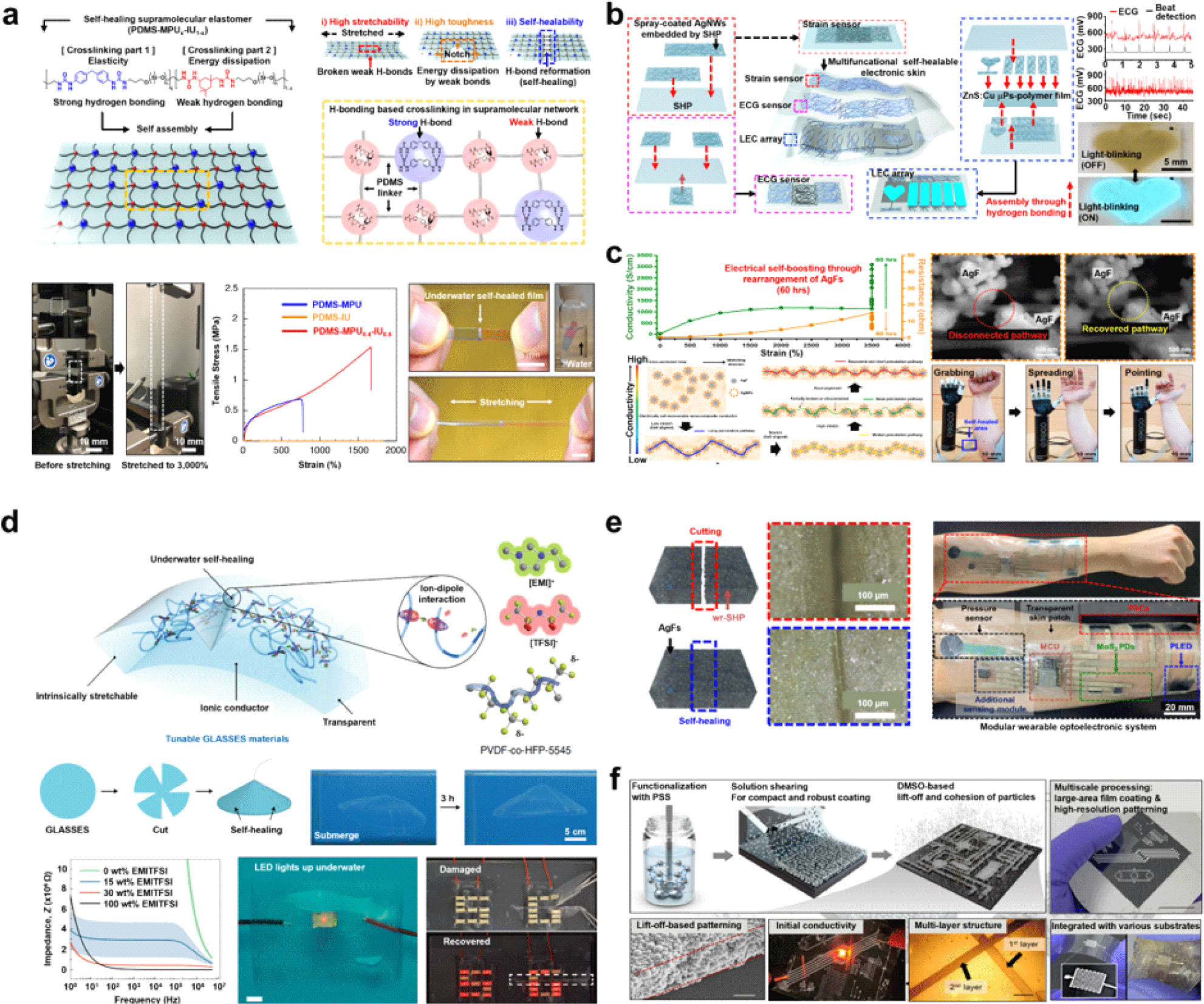
이어 Zhenan Bao 교수팀은 기존 발표했던 PDMS 기반의 높은 강성을 가진 자가치유 고분자(PDMS-MPU0.4-IU0.6)에 탄소나노튜브 및 은 나노 와이어와 같은 1차원 전도성 필러를 넣은 나노 복합체를 개발하여, 손상 후 자가치유된 뒤에도 기계적 특성과 전도성 회복을 꾀하였다(Fig. 1(b))[25]. 전도성 네트워크가 손상되었음에도 불구하고, 자가치유 고분자 매트릭스에 둘러싸여 동적 재구성을 따라가 전도성 경로가 회복됨을 확인하였다. 탄소나노튜브 및 은 나노 와이어 전도성 네트워크가 대부분 고분자 표면에 집중되어 ‘표면 효과(surface effect)’로 전도성 회복 과정이 강화되었고, 고분자 매트릭스의 낮은 유리 전이 온도(Tg)와 동적 가교가 함께 작용해 자가치유 과정에서 균열 부위로 1차원 전도성 필러가 고분자와 함께 이동해 전도성이 유지된 것으로 보인다. 본 연구팀은 각각의 요소를 전자 피부 소자로 활용하면서 신축성과 자가치유 기능을 갖춘 최초의 통합 다기능 전자 피부 시스템을 제작하였다. 소자의 자가 결합 특성과 전도성을 활용하여 light emitting diode(LED) 회로를 연결하는 인터커넥트 배선과, 손상을 입어도 전도성을 회복하여 내구성이 높은 심전도 센서 및 스트레인 센서, 탄소나노튜브 및 은 나노 와이어 전극과 함께 구리가 도핑된 황화아연 입자를 발광층으로 이용한 발광 커패시터 구조의 light emitting capacitor(LEC) 디스플레이를 개발하였다. LEC 디스플레이를 통해 심박수 변화나 스트레인 값을 출력해 시각화 하는 등 자가치유 가능한 온보드 시스템 내의 이러한 단일 플랫폼은 추후 로봇 혹은 보철 전자 피부에 매우 유용할 것으로 보인다.
또한, 본 연구팀은 2차원 전도성 은 플레이크 복합체 전극이 연신 환경에서 시간이 지날수록 전도성이 회복됨을 밝혀내고 해당 소재를 활용해 신축성 자가치유 고분자 복합체 전극을 제작하였다(Fig. 1(c))[26]. 기존 액체 금속 및 1차원 나노 물질을 활용한 전도층은 신축성이 있고 자가치유 가능한 전극으로 활용될 수 있었지만, 자가치유 기판에 반투명 전극으로 증착 되어 두 개의 절단된 전극 사이의 표면에서 전도층을 정렬하는 것이 어려워 전기 전도도의 자가치유 효율이 낮은 문제가 있었다. 그러나 3,500% 인장 변형에서도 1,137 S/cm의 높은 전도성을 보였던 본 전극은 특히 60시간에 걸쳐 점진적으로 3,086 S/cm까지 증가하는 전기적 자가 증강 현상(electrical self-boosting)을 발견하였다. 이 현상은 1,700% 이상의 변형에 대한 신축성 및 자가치유가 가능한 나노 복합체 전도체에서 전기적 경로가 재구성되어 전도성이 증가하는 현상을 의미한다. 은 플레이크 주변에는 늘어난 고분자의 동적 특성에 반응해 자발적으로 은 나노 입자가 생겨나는데, 본 연구팀은 computed tomography(CT) 및 scanning electron microscopy(SEM) 이미지를 통해 전기적 자가 증강 현상이 자가치유 고분자의 효율적인 변형 에너지 분산 효과와 함께, 은 나노 입자에 의해 둘러싸인 은 플레이크의 자가 정렬 효과로부터 발생한다는 것을 확인하였다. 즉, 나노 복합체가 늘어날 때, 은 플레이크와 은 나노 입자가 자발적으로 변형 방향으로 자가 정렬되면서, 입자 간의 밀접한 접촉이 전도도를 향상시키는 것이다. 이러한 특성을 가진 나노 복합체 전극 배선을 활용하여 본 연구팀은 배선이 완전히 절단된 뒤에도 자가치유를 통해 근전도(electromyography, EMG) 신호를 얻고 로봇 팔을 제어함으로써 보철 활용 가능성을 성공적으로 입증하였다.
한편, 물속 혹은 체액 환경에서의 기존 자가치유 고분자는 물분자가 결합에 관여해 치유 및 결합 능력이 떨어지는 단점이 있었다. 또한, 전도성 자가치유 고분자는 금속 입자를 수소 결합이 채워진 고분자의 매트릭스로 활용했기 때문에 불투명하여 재료 활용에 한계가 있었다. 싱가포르 국립대학교 Benjamin Tee 연구팀은 해양생물에서 영감을 받아 투명한 전도성 고분자를 사용하여 건조한 상태와 습기 있는 상태 모두에서 자가치유 가능한 소재를 개발하였다(Fig. 1(d))[13]. 본 자가치유 소재는 극성이 강한 플루오린기가 풍부한 비결정성 고분자인 poly(vinylidene fluoride-co-hexafluoropropylene)(PVDF-HFP)와 안정적이고 잘 증발하지 않는 이온성 액체 1-ethyl-3-methylimidazolium bis (trifluoromethylsulfonyl) imide ([EMI]+[TFSI]−, EMITFSI) 를 사용하였다. PVDF-HFP의 탄소-플루오린 간 공유 결합은 높은 전기 음성도를 가져 물분자와의 상호작용이 약하다. 이온성 액체는 비공유 결합 중 하나인 이온- 쌍극자 상호작용을 통해 양이온과 고분자 사슬의 쌍극자와 강하게 상호작용하고, HFP의 CF3는 입체장애 효과로 이온이 잘 이동할 수 있게 해준다. 이러한 성질을 활용하여 더 높은 이온 전도성과 자가치유 능력을 제공하는 본 소재는 고분자와 이온성 액체의 높은 혼화성을 가져 가시광선 파장 아래 평균 98% 이상의 투명성도 유지한다. 탈이온수, 산성 및 알칼리 같은 여러 수분 환경에서 최대 2,000%의 변형률과 10−3 S/cm의 전도성을 가지며 회복 후에도 안정적으로 LED가 동작함을 보였다.
성균관대학교 손동희 교수 연구팀은 할라이드 페로브스카이트, 2차원 나노 시트와 같은 광활성 나노 박막의 유연한 광전자 소재를 활용하여 에너지를 수집하고 촉각을 감지해 해당 정보를 디스플레이로 나타낸 모듈형 웨어러블 광전자 시스템을 개발하였다(Fig. 1(e))[27]. 통합 시스템에는 생체 신호 감지 유닛, 디스플레이 시각화 유닛, 전원 공급 유닛 등 전기를 빛으로 혹은 그 반대로 변환하는 광활성 반도체가 많이 활용되는데, 기존의 광전자 소재들은 변형성이 부족해 유연한 피부와 같은 플랫폼에 재구성 가능한 시스템으로 활용되지 못하거나, 습기와 열에 대해 본질적으로 불안정한 문제가 있었다. 이에 연구팀은 기존 발표된 연구에 영감을 받아 광전자 소재에 필수적인 방수 및 투명성을 가진 자가치유 고분자 특성을 활용한 연구를 진행하였다. 물리적 및 전기적으로 사용자의 정의에 따라 구성하고, 안정적인 작동을 위해 광활성 소재 전체가 캡슐화된 시스템을 제작하기 위해서 본 연구팀은 플루오린화된 반결정성 및 열가소성 고분자인 poly (vinylidene fluoride-co-hexafluoropropylene)(p-PVDF–co-HFP)를 기반으로 한 방수 자가치유 고분자를 제작하였다. 은 플레이크가 함유된 자가치유 고분자 전도성 복합체를 전극과 배선 모두에 적용하여 사용자 정의에 따라 모양과 크기 및 기능을 쉽게 재구성할 수 있는 다기능 피부 센서를 완성하였고, 광전지 및 발광 소자를 통해 효율적인 전원 공급 및 시각화, 움직임과 밝기 감지를 가능하게 하였다.
피부에 적용할 수 있는 이러한 차세대 웨어러블 기술의 핵심요소는 신축성 있는 전극과 인터커넥트 배선이다. 기존 금속 재료로 설펜타인 혹은 웨이브 모양의 구조로 제작해 신축성을 부여하는 방법은 기하학적으로 고밀도 집적이 어렵고 금속 특성으로 인해 신축성이 제한된다. 또한, 금속 복합체 혹은 전도성 고분자와 같은 신축성 소재는 전도성이 부족하거나 전통적 포토리소그래피 공정과 호환이 어렵다는 단점이 있다. 이러한 문제를 해결하기 위한 대안으로 액체 금속이 주목받고 있다. 특히, eutectic Gallium-Indium (EGaIn)은 상온에서 액체 상태를 유지하면서도 높은 전도성을 제공하여 유연성과 복원력이 요구되는 웨어러블 전자소자에 적합하다. 그러나 EGaIn은 표면에 산화층이 형성되어 전도성이 저하될 수 있으며, 정밀한 패터닝이 어려운 한계가 있다. 이런 문제를 극복하기 위해 카이스트 스티브 박 교수 연구팀은 EGaIn의 패터닝 기술을 개발하였다. 이 연구팀은 산업 제조 공정과 통합할 수 있는 방법으로 EGaIn을 안정적으로 패터닝하여 신축성 있는 전극을 제작하는 데 성공하였다(Fig. 1(f)) [28]. 손상이 있어도 다시 연결이 가능한 액체 형태의 EGaIn 적용은 표면에 산화층이 절연체로 작용하여 추가적인 공정이 필요하였고 이로 인한 단락과 수율의 문제도 있었다. 그러나 본 연구팀은 poly(styrene sulfonate)(PSS)를 통해 EGaIn의 안정성을 높이고 얇고 균일한 필름을 코팅할 수 있게 해주었으며, 포토리소그래피 리프트-오프 과정에서 dimethyl-sulfoxide (DMSO) 를 사용하여 액체 금속을 응집시켜 필름을 전도성으로 만들어 주었다. 이러한 액체 금속 패터닝 기술을 이용하여 PDMS 등의 부드러운 기판 위에 다양한 크기로 패터닝을 하였고 피부의 압력 감지 능력을 모방하기 위해 감지 픽셀을 고밀도(5 mm 이하)로 배치하여 고해상도 압력 감지 어레이를 개발하였다. 전체 3 cm×3 cm 크기에 64개의 압력 감지 픽셀을 넣어 50%의 변형이 가해져도 안정적인 회로 작동을 가능하게 하였고 550 kPa의 압력이 가해진 상태로 10,000회의 접촉을 시켜도 일관된 저항 변화를 보였다. 또한, 생체 적합성과 견고함 덕분에 EMG 센서를 위한 생체 인터페이스 전극을 시연함으로써 바이오 전자소자의 활용 가능성을 보였다.
피부에 적용되는 바이오 전자소자가 실시간 건강 모니터링과 치료에 유용한 솔루션을 제공한다면, 임플란터블 소자는 체내 조직 및 장기와 장기적으로 정밀하게 인터페이스를 형성하는 데에 중점을 둔다. 임플란터블 소자는 생체 적합성, 장기간의 전기적 안정성, 반복적인 움직임에도 견고한 내구성, 연조직에 기계적으로 적응할 수 있는 특성 등이 요구되며, 이는 신경 자극이나 지속적인 바이오 센싱과 같은 의료 치료에 필수적이다.
신경계를 대상으로 하는 신경학적 질환에 대한 전자의학의 관점에서 말초신경의 기계적 특성과 유사하도록 적절히 부드럽고 신축성이 요구되는 소재 개발은 어려운 과제였다. 기존 말초신경에 적용했던 커프(cuff) 형태의 전극은 지속적인 신경 압박으로 인해 형태가 변형되어 내부 조직이 괴사하거나 혈류량이 감소하는 위험성도 있었다. 이에 성균관대학교 손동희 교수 연구팀은 자가치유 고분자(PDMS-MPU0.4-IU0.6)와 금 나노 박막을 코팅한 은 플레이크/고분자 복합체 전극을 이용하여 신경 압박을 최소화한 부드러운 신경 인터페이스를 개발하였다(Fig. 2(a))[29]. 자가치유 고분자의 동적으로 가교된 특성 덕분에 기계적 응력이 효과적으로 완화될 수 있었고, 이를 기반으로 말초신경과 소자 간의 기계적 모듈러스 차이를 크게 줄일 수 있었다. 고분자의 뛰어난 압박 완화 정도는 dynamic mechanical analysis(DMA)와 finite element analysis (FEA) 시뮬레이션 결과로 확인하였다. 은 이온의 체내 유출을 최소화하기 위해 금 나노 박막을 복합체 표면에 전사하였고, 최대 100%까지 늘려도 금 나노 박막의 균열에 따른 세포 독성은 나타나지는 않았으며, 쥐를 대상으로 한 in vivo 실험에서 체내 삽입 32주 후 17.03 ppm의 소량만이 검출되었다. 연구팀은 자가치유 고분자의 자가 접합 특성을 이용해 접착제나 봉합시술 없이 쉽게 쥐의 말초신경에 전극을 적용하였으며 14주간의 기간 동안 신경 신호를 계측하고 전기 자극을 통해 다리 움직임을 조절하였다.
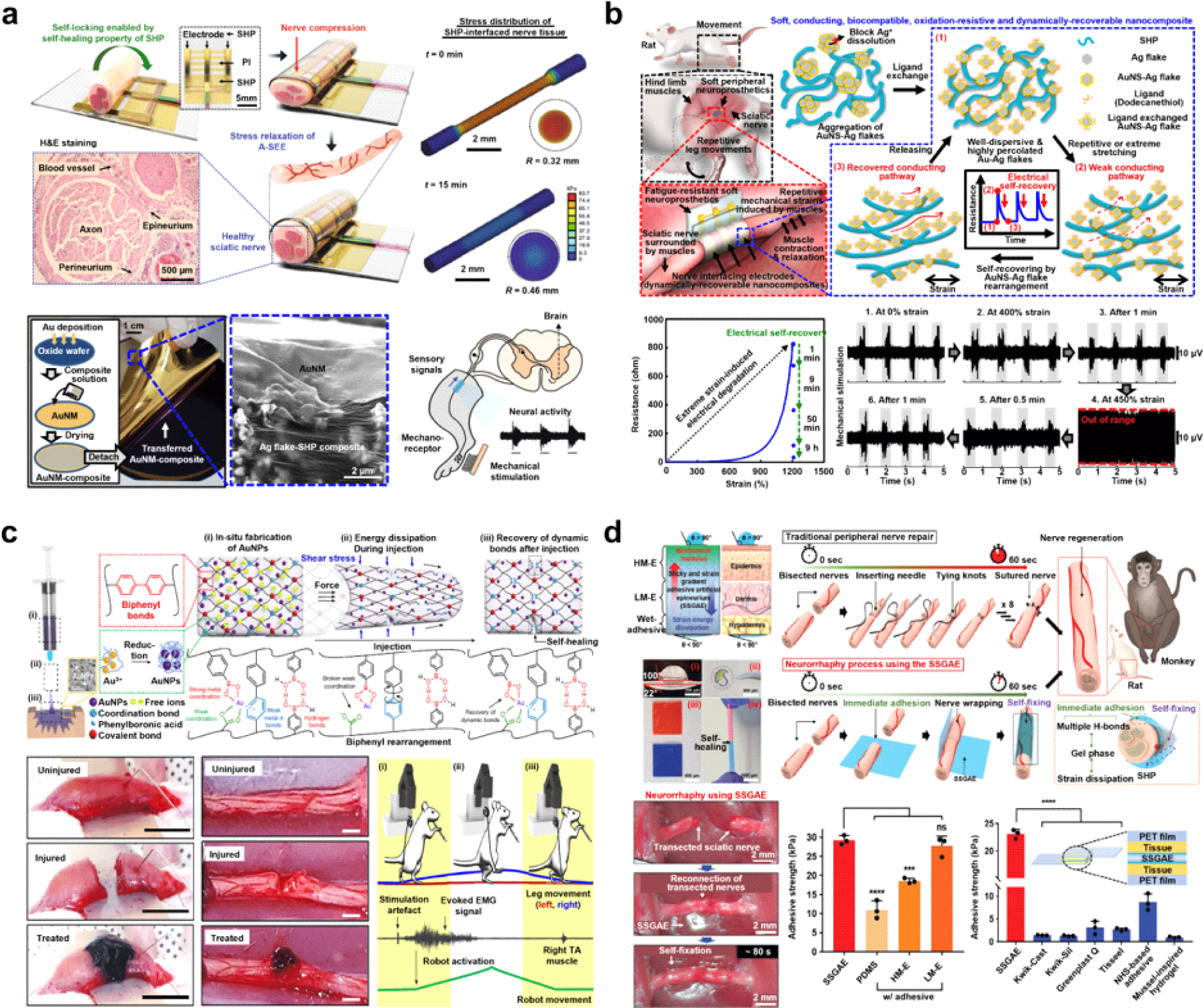
이후 본 연구팀은 응력 완화 특성을 기반으로 한 신경 인터페이스의 생체 적합성 문제에 주목하였다. 은 금속을 기반으로 한 소재는 높은 전도성을 갖지만 생체 내에서 산화하거나 은 이온이 독성을 띠는 단점이 있었다. 이에 신축성 있는 자가치유 고분자에 나노 쉘로 코팅된 은 플레이크를 넣은 나노 복합체 전극을 제작하였다(Fig. 2(b))[30]. 자가치유 고분자 사슬 내에 고르게 분산된 플레이크 하나하나를 금 나노 쉘로 코팅됨으로써 주변에 은 이온 나노 입자가 더 이상 관찰되지 않았고 동시에 생체 유출도 방지할 수 있어 성능을 개선하였다. 또한, 1,200%의 변형에도 자가치유 고분자로 캡슐화된 나노 복합체는 빠르게 본래 전도성을 회복하여 뛰어난 자가 회복 능력을 보여줌으로써 기계적 응력 하에 은 입자들이 동적으로 재배열되며, 전도성을 자발적으로 회복한다는 사실을 밝혀내었다. 이러한 특성을 쥐의 말초신경에 적용하여 반복적인 움직임으로 극심한 피로를 받을 수 있는 상황에서도 양방향 신경 인터페이스의 기능을 5주간 유지하였다. 마지막으로 연구팀은 소자를 늘린 상황에서 전도성이 회복됨에 따라 실시간으로 정상화되는 신경신호를 확인하였고, 심층신경망(deep neural network, DNN) 기술을 통해 쥐의 신경신호 패턴으로부터 보행상태를 분석하여 신경 보철 기기의 새로운 포문을 열었다.
동적인 수소 결합 기반의 자가치유 고분자 외에도 하이드로겔은 우수한 물성 덕분에 예로부터 조직 인터페이스 소재로 주목받아 왔다. 특히 신경이나 근육이 움직이면서 발생할 수 있는 전단력에 효과적으로 대응하며 다양한 구조의 생체 조직과 밀접한 접촉을 유지하는 데에 유리하다. 그러나 기존 하이드로겔은 체액이나 응력의 영향으로 체내에서 쉽게 물러지거나 분해되는 한계로 인해 그 사용이 제한되었다. 이를 해결하기 위해 성균관대학교 신미경 교수 연구팀은 하이드로겔의 내구성과 생체 적합성을 동시에 향상시킬 수 있는 주사주입형 조직 인터페이싱 하이드로겔을 개발하였다(Fig. 2(c))[31]. 이들이 개발한 하이드로겔은 주사 주입이 가능하며, 신경 접착성을 지녀 작고 미끄러운 신경 조직 표면에서도 안정적인 인터페이싱 특성을 보였다. 또한, 페닐보레이트 기반의 비가역적 바이페닐 결합과 가역적 다중 비공유 결합을 구현하여 전도성 금 나노 입자와의 강력한 배위결합, 수소 결합, 금속-π 결합, 금속-카복실레이트(Au³⁺–COO⁻) 상호작용과 같은 비공유 초분자 결합을 통해 전기 전도성을 제공하였다. 페닐보레이트 기반 다중 결합 전략은 외부 자극을 받을 때 약한 비공유 결합의 해리와 바이페닐 결합의 이방향 재배열을 통해 에너지를 효과적으로 분산시켜 재료의 주사 주입 중 전단 응력에 대한 반응과 주입 후 자가 회복을 가능하게 한다. 더 나아가, 하이드로겔은 신경 조직에 대해 8.8 kPa 수준의 탁월한 접착성을 보이며, 신경에 주사된 후 신경의 스트레칭이나 굽힘 상태에서도 안정적으로 유지되어 신경에 안정적으로 접촉할 수 있었다. 이러한 하이드로겔은 손상된 근육과 신경 부위에 주사주입되어 조직 재생을 위한 스캐폴드 역할뿐만 아니라, 전기적 통로로써 양방향 신경 및 근육 신호 전달을 지원하는 데 활용할 수 있었다. 특히, 하이드로겔은 초기 단계에서도 효율적으로 전기 자극을 전달해 손상된 조직의 감각 및 운동 기능을 효과적으로 회복시켰다. 이를 통해 손상된 근육 조직에 주사된 하이드로겔이 로봇 보조 재활 시스템에서 감각 및 운동 신호 전달을 지원함으로써, 심각한 근육 손실이 발생한 쥐의 보행 기능을 빠르게 회복하는 데 기여할 수 있었다.
주사주입 가능한 하이드로겔 외에도 뛰어난 접착력을 활용하여 절단된 신경을 직접 봉합할 수 있는 기술도 존재한다. 지금까지의 신경 봉합술은 봉합실로 바느질하였기 때문에 의료진에게 과도한 시간과 집중력을 요구하였고 수술 후에는 남아있는 실이 축삭의 재생을 방해하여 부상 전 상태로 완전한 회복이 어려웠다. 또한, 출혈이 발생하거나 실로 인한 신경 압박, 그리고 외부 물질이 봉합사 사이로 유입되어 섬유화 위험성이 있었다. 이러한 문제를 해결하기 위해 성균관대학교 손동희 교수 연구팀은 피부의 다층 구조에서 영감을 받아 질긴 외부와 부드러운 내부 구조를 떠올려 생체 친화적인 자가치유 능력을 가진 신경 봉합 패치를 발표하였다(Fig. 2(d))[32]. 개발된 패치는 외력을 효과적으로 분산시키는 수소 결합을 포함한 자가치유 고분자(PDMS-MPU-IU) 두 층과 뛰어난 조직 접착력을 지닌 접착 하이드로겔(alginate conjugated with boronic acid, Alg-BA) 한 층의 계층 구조 덕분에 안정적으로 절단된 신경을 연결하였다. 높은 탄력성을 가지고 외부 박테리아와 병원체에 대한 장벽 역할을 하는 표피와 점탄성을 가지고 표피를 지탱하는 진피를 자가치유 고분자로 모사함으로써 외력을 분산하였다. 특히, 가장 낮은 모듈러스를 가진 피하 조직을 하이드로겔로 모사하여 기계적 특성을 유지하면서도 조직과 소자간 강력한 접착력(29.3±1.9 kPa)을 얻었으며, 세 층의 시너지 효과를 통해 즉각적이고 안정적인 신경 봉합이 가능하도록 하였다. 신경 접착 하이드로겔을 적용하였을 때, 각 층이 따로 있을 때보다 세 층이 함께 있을 때 접착력이 우수하고, 타 의료용 접착제보다 월등히 접착 성능이 뛰어남을 확인하였다. 이 외에 숙련된 전문의가 절단된 신경 1가닥을 연결하는 데 약 10분이 소요되는 반면, 개발된 신경 봉합 패치를 사용하면 숙련도에 관계없이 약 1분 이내에 신경을 봉합할 수 있으며 설치류 모델에서 기존 봉합사 방법과 조직 재생 정도가 유사함을 확인하였다. 특히, 인체 해부학과 기능이 매우 유사한 영장류의 손목 정중 신경을 절단한 후 봉합한 결과, 약 1년 뒤에 엄지 손가락의 움직임이 거의 정상 수준으로 회복하였다.
말초신경계가 신체의 각 부위로부터 신호를 전달하고 그에 반응하는 중요한 역할을 한다면, 중추신경계는 신체 전반의 기능을 총괄하고 조율하는 핵심적인 역할을 한다. 특히, 뇌는 신경 신호의 생성 및 통합을 담당하며, 생각, 감정, 운동 제어 등의 복잡한 작업을 수행하는 인간의 가장 중요한 기관이다. 따라서 뇌와 직접 상호작용하는 바이오 전자소자는 더 높은 수준의 정밀성과 안정성을 요구하며, 장기적으로 신경 조직과 일관성 있게 소통할 수 있어야 한다. 뇌에 적용되는 바이오 전자소자는 신경 자극과 기록뿐만 아니라 뇌 질환의 진단 및 치료에도 중요한 역할을 할 수 있다. 뇌 조직의 복잡한 구조와 부드러운 특성으로 인해, 뇌에 안정적으로 부착하면서도 장기적인 사용에 적합한 부드럽고 신축성 있는 소재가 필수적이다.
최근 자가치유 기능을 포함한 신축성 소재와 하이드로겔을 적용한 소자는 이러한 요구사항을 충족시키며, 특히 파킨슨병이나 뇌전증과 같은 뇌질환의 치료에 유망한 접근법으로 주목받고 있다. 성균관대학교 손동희 교수팀은 뇌전증 발작 치료에 효과적으로 알려져 있는 경두개 집속 초음파(transcranial focused ultrasound, tFUS) 자극에도, 소자가 안정적으로 부착 유지를 할 수 있도록 자가치유 고분자와 접착 하이드로겔을 결합한 뇌피질전도(electrocorticography, ECoG) 전극을 개발하였다(Fig. 3(a))[33]. 본 센서는 카테콜이 결합된 형태의 점탄성 하이드로겔 접착제(alginate conjugated with catechol acid, Alg-CA)와 16개의 채널을 가진 설펜타인 모양의 금 전극, 그리고 낮은 모듈러스를 가진 자가치유 고분자(PDMS-IU)로 구성되어 24주 동안 성공적으로 뇌파 신호를 관측하였다. 이온 전도성 하이드로겔 층인 Alg-CA는 가역적인 비공유 초분자 결합을 통해 뇌와 전자소자 간의 즉각적이고 강한 접착성(23.9 kPa)을 보여 초음파 자극에도 견딜 수 있도록 하였다. 고분자층인 PDMS-IU는 기계적 변형에 대한 내성을 높이고 지속적인 스트레스 완화를 통해 ECoG 신호를 안정적으로 계측할 수 있게 해주었으며 곡률 형태를 가진 뇌의 표면을 따라 밀접하게 접촉하게끔 하였다. 고분자 기판에 전사 인쇄된 설펜타인 모양의 금 전극은 고분자 기판에 열과 압력을 통해 안정적으로 내장되며 반복되는 연신환경 하에서도 일관된 전기적 특성을 보였다. 특히, 연구팀은 기존 의료용 장치가 고정된 신경 자극 초음파 프로토콜만을 사용한다는 것에 주목하여 신경 생리학적 피드백에 기반해 센서를 통하여 읽은 발작 신호의 심각도에 따라 최적의 치료 프로토콜을 수행할 수 있는 폐쇄형 시스템을 제작하였다. 기존 신경 자극 방법과 차별화된 본 접근 방식은 개인 맞춤형 치료가 가능하다는 점에서 뇌질환 치료를 비롯한 바이오 전자분야에 혁신적인 변화를 가져올 것으로 기대된다.
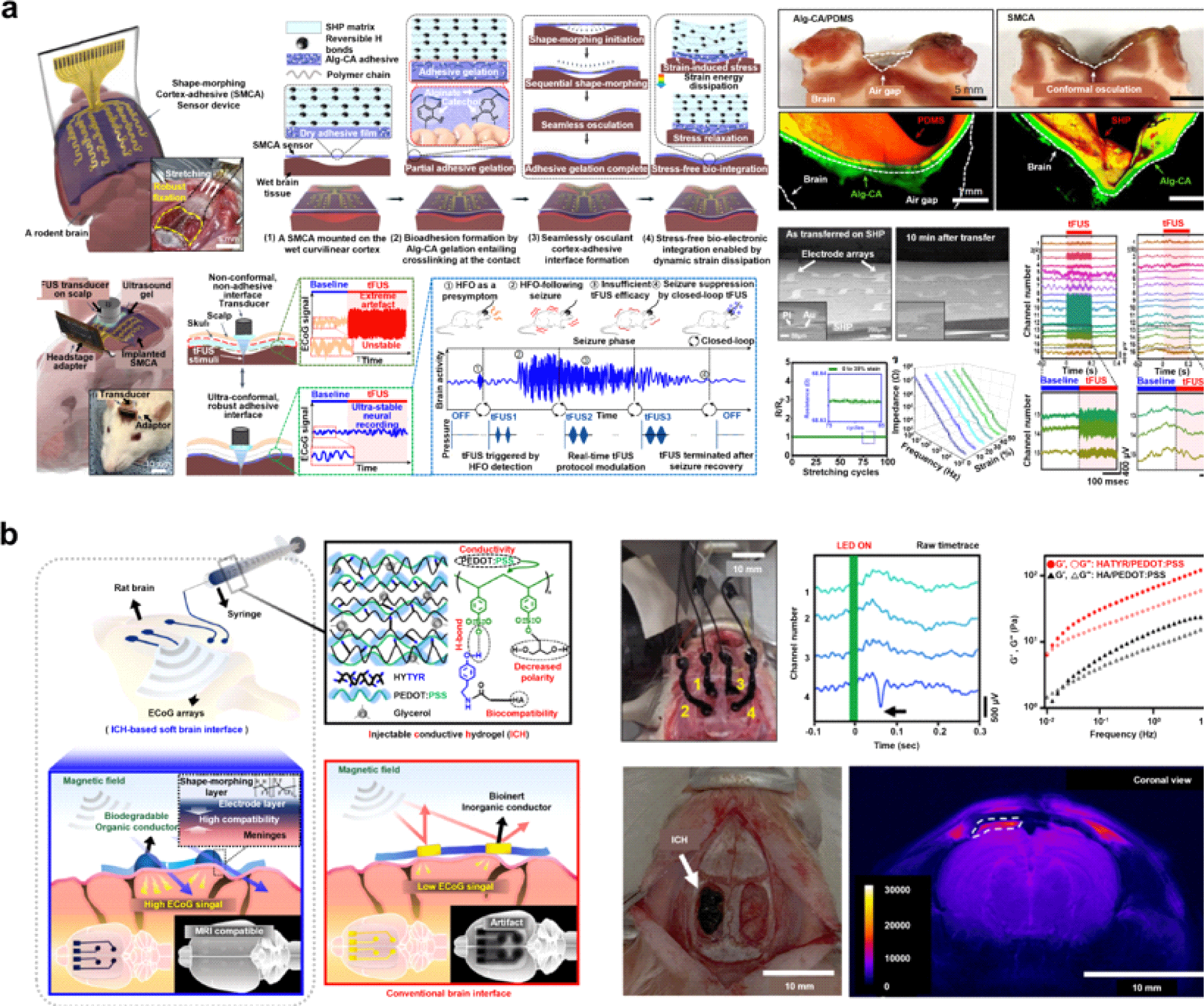
이와 같이 유연하고 신축성 있는 소재는 뇌질환을 실시간으로 모니터링하는 신경 인터페이스에 상당한 기여를 하였으나, 뇌 신경 회로를 더 깊게 이해하기 위해서는 magnetic resonance imaging(MRI)와 결합되어 이미지를 살펴보는 것이 필요하다. 이에 해당 연구팀은 MRI와 호환되는 뇌 인터페이스 전극을 위한 티라민이 결합된 히알루론산(tyramine-conjugated hyaluronic acid, HATYR)과 poly(3,4-ethylenedioxythiophene)-poly(styrenesulfonate)(PEDOT: PSS)으로 구성된 주사주입형 전도성 하이드로겔을 개발하였다(Fig. 3(b)) [34]. HATYR 고분자는 효소적 가교 결합을 가능하게 해 시간에 따라 주사주입이 가능하였고, MRI와 호환하기 위하여 공명 주파수 변화 위험이 있는 무기 금속 대신 유기 전도성 물질인 PEDOT: PSS를 사용하였으며, HATYR의 페놀 그룹과 PSS의 술폰 그룹 간의 수소 결합을 통해 가역적인 이온 가교 초분자 결합 및 패터닝이 가능하도록 주입가능한 겔화를 이루어냈다. 이렇게 만들어진 전도성 하이드로겔은 주사주입 방식을 통해 200 μm 이하의 고해상도로 패터닝되어 ECoG 다채널 전극 어레이로 제작되었으며 실제 MRI 이미징 과정에서 공명 왜곡 없이 명확하게 촬영됨과 동시에 시각 피질에서 ECoG 신호를 성공적으로 기록하였다.
중추신경계인 뇌는 매우 미세한 움직임과 함께 정밀한 신호 처리가 이루어지는 반면 심장은 신체에서 가장 극심하게 변형되는 기관 중 하나로, 지속적으로 수축하고 이완하는 동작을 수행한다. 심장 조직은 부드러운 모듈러스를 가짐과 동시에 혈류에 대한 저항이 적기 때문에 심장에 적용되는 소자는 높은 수준의 기계적 유연성과 내구성을 요구하며, 전기적 신호를 안정적으로 감지하고 심장 박동 조절을 위한 정밀한 자극 기능을 수행해야 한다.
서울대학교 김대형 교수 연구팀은 이 문제를 해결하기 위해 전도성과 생체 적합성에서 강점을 가지는 은-금 나노 와이어 복합체 필러를 개발하였다(Fig. 4(a)) [35]. 이 나노 와이어는 높은 종횡비를 가지고 있어, 퍼콜레이션 임계치를 크게 낮추는 특성을 지닌다. 종횡비는 나노 와이어의 길이와 직경의 비율을 의미하는데, 일반적으로 종횡비가 높은 구조는 전도성 네트워크 형성을 더 쉽게 하여 전자 이동 경로를 확보할 수 있어 높은 전도성을 제공한다. 그러나 은 나노 와이어는 산화 및 부식에 취약하여 장기간 생체 환경에서 안정성을 유지하기 어려운 한계가 있다. 이를 해결하기 위해 연구팀은 은 나노 와이어에 금을 코팅하여 보호막을 형성하였다. 이 금 코팅은 은 이온의 유출을 방지할 뿐만 아니라, 산화 및 부식으로부터 은을 보호하여 나노 와이어의 장기적인 안정성과 생체 적합성을 크게 향상시킨다. 연구팀은 이 금-은 나노 와이어 복합체를 얻기 위해 헥실아민, 금-은 나노 와이어, poly(styrene-butadiene-styrene)(SBS) 고분자와 톨루엔을 혼합한 후 건조 캐스팅 과정을 통해 미세 구조를 형성하였다. 이 과정에서 금-은 나노 와이어와 헥실아민이 풍부한 영역과 SBS 고분자와 톨루엔이 풍부한 영역으로 상분리됨을 발견하였고, 결과적으로 금-은 나노 와이어가 풍부한 영역은 안정적인 전기 전도도를 유지하는 반면, SBS가 풍부한 영역은 탄성 구조의 지지대 역할을 하였다. 이를 통해 연구팀은 최적의 전도성과 신축성의 균형을 이루는 6:4의 나노 와이어 복합체 무게 비율을 찾았다. 이렇게 최적화된 복합체는 전도성(41,850 S/cm)이 뛰어나면서도 최대 266%까지 늘어날 수 있는 신축성을 확보하였다. 이를 바탕으로 연구팀은 MRI로 얻은 돼지 심장의 심실 전체 표면을 원뿔대 모양으로 단순화한 후, 평면의 부채꼴 형태로 펼쳐 메쉬 형태의 다채널 전극을 제작하였다. 이 메쉬는 30% 이내의 신장 범위를 가지는 심장의 움직임 내에서도 전기적 성능 변화가 거의 없음을 확인하였으며, 급성 부분 허혈이 유도된 돼지 심장 모델에 이식하여 시간과 위치에 따라 정확히 구분된 심전도(Electrocardiogram, ECG)를 성공적으로 계측하였다.
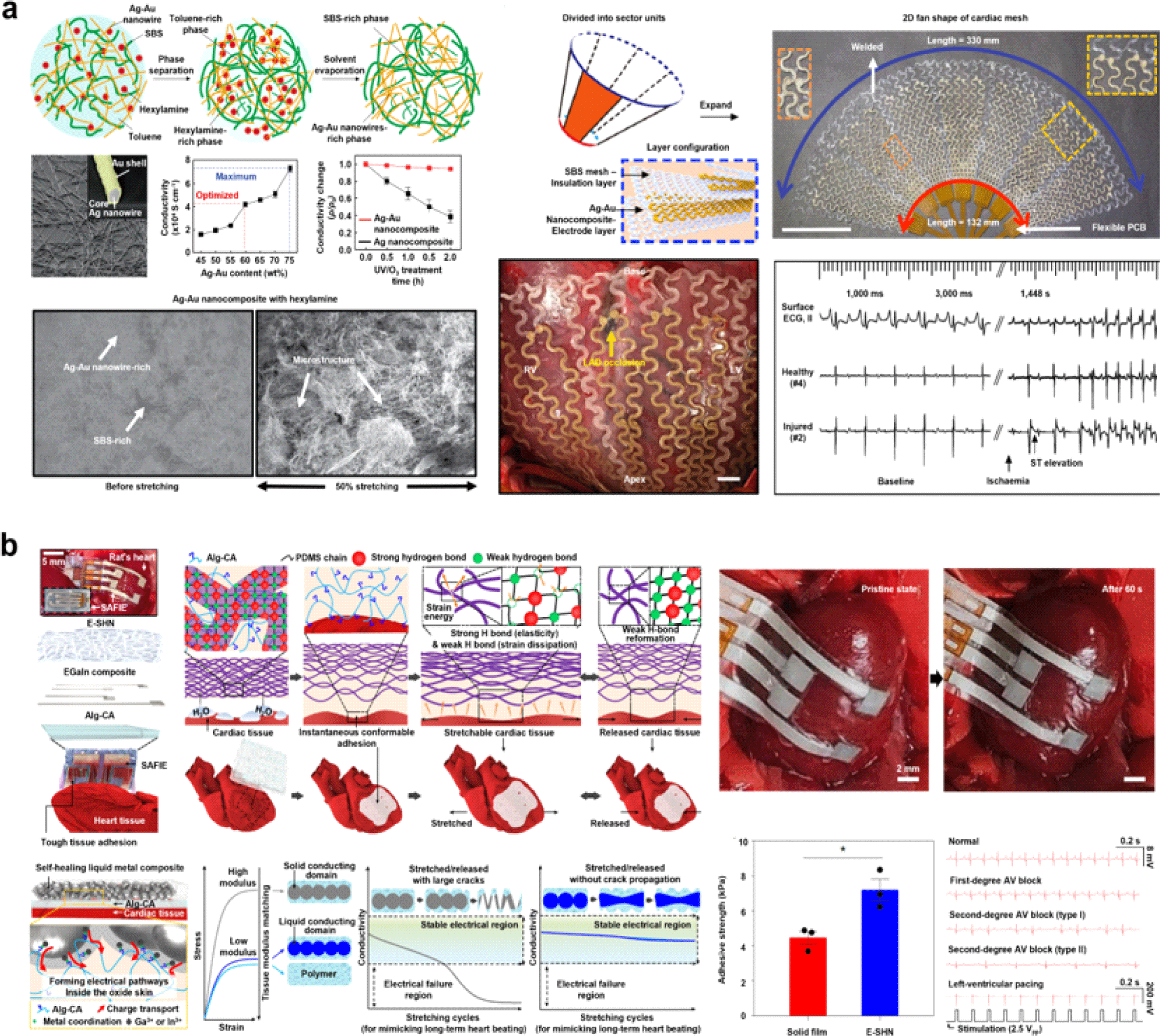
심장 조직의 지속적인 운동성과 복잡한 표면 구조를 감안할 때, 고체 상태의 전도성 물질을 섞은 고분자 복합재는 그 자체로 유연성과 기계적 순응성에 제한이 있을 수 있다. 따라서, 전자소자가 수축 이완을 반복하는 심장에 염증 없이 장기간 안정적으로 부착되기 위해서는 조직에 강하게 접착할 수 있는 소재와 피로 저항성 및 응력 완화 특성이 필요하다. 성균관대학교 손동희 교수 연구팀은 신축성 있으면서도 응력에 내구성을 갖는 네트워크 구조의 자가치유 고분자 기판층(PDMS-MPU-IU), 이온 전도성을 가지고 조직과 뛰어난 접착성을 자랑하는 하이드로겔 층(Alg-CA), 전기적 내구성이 뛰어나면서도 피로에 강한 액체 금속(EGaIn) 필러-자가치유 고분자(PDMS-MPU-IU) 복합체 전극층으로 구성된 심장 전자 패치를 개발하였다(Fig. 4(b))[36]. 특히, 조직과 비슷한 모듈러스를 가진 접착 하이드로겔 층으로 인해 외부 자극 없이 심장 조직에 즉각적으로 접착할 수 있고, 전기 방사를 통해 만든 다공성 네트워크 구조와 하이드로겔이 물리적으로 얽혀 있어 일반 고분자 필름과 비교했을 때 응력 완화 효과와 함께 더 월등한 조직 접착이 가능해진다. 액체 금속 복합체 전극층 주위에는 산화물 층이 형성되어 안정적인 전하 주입을 방해할 수 있지만, 하이드로겔을 적용함으로써 산화물 층과 금속 배위를 형성하며 심장 조직으로 효율적인 전하 주입이 가능해짐을 확인하였고, 응력이 발생했을 때 액체 금속 입자가 동적으로 재배열하며 전도성을 유지할 수 있었다. 실제 설치류의 심장 조직에 접착 패치를 적용하였을 때, 4주 동안 심장 신호를 정확히 획득하는 동시에 공간이 생기거나 미끄러지는 문제없이 완전히 밀착되어 부착되는 것을 확인하였다. 또한, 부정맥을 유발한 모델에서 부정맥의 단계를 진단하고 전기자극을 통해 치료까지 가능한 양방향성 패치임을 보였다.
3. 결론 및 전망
본 원고에서는 신축성 있는 자가치유 고분자와 액체 금속, 그리고 하이드로겔 등을 활용한 바이오 전자소자 기술이 피부를 비롯한 신체의 다양한 장기에 적용된 최신 연구 사례를 종합적으로 검토하였다. 특히, 생체 접착 기술은 생체 조직과의 기계적 적합성 및 장기적인 안정성을 유지하면서, 응력 완화 특성이 있는 자가치유 소재를 통해 반복적인 인장 환경 하에서도 피로 회복이 가능한 특징을 보였다. 이러한 기술들은 생체 적합성 및 장기간 신호 전달 성능을 극대화하는 데 중요한 역할을 할 것으로 기대된다.
그럼에도 앞으로의 연구에서는 여러 중요한 과제가 남아 있다. 우선, 장기적인 안정성을 보장할 수 있는 접착 소재 개발이 필요하다. 이는 생체 내에서 기계적 스트레스를 효과적으로 완충하고, 조직 손상을 최소화할 수 있는 소재의 개발로 이어져야 한다. 또한, 자가치유 소재의 내구성과 성능을 개선하는 연구가 필수적이다. 특히 임플란터블 장치의 경우 화학 구조와 동작 원리에 대한 심도 있는 연구와 함께, 반복적인 손상과 회복 과정에서도 장기간 안정적으로 기능을 유지할 수 있는 고성능 소재가 요구된다.
기존 자가치유 고분자는 자가치유 방법에 따른 신축성, 기계적 특성 및 자가치유 효율 등 복잡한 상관관계를 가지고 있다. 내재적인 자가치유 방법은 공유 결합의 재형성이나 자유 라디칼, 초분자 동적 결합 등을 기반으로 하여 반복적인 치유를 가능하게 한다[16]. 하지만 많은 고분자의 경우, 자가치유에 요구되는 온도가 여전히 높아 실용성이 떨어진다. 앞서 언급하였듯이 치유 온도는 고분자의 Tg와 관련이 있는데, 높은 Tg는 자가치유 효율을 저하시킬 수 있으며, 고분자의 유연한 구조 설계는 Tg를 낮추지만 비강성 구조와 기계적 특성의 저하를 초래하여 구조적 안정성을 떨어뜨릴 수 있다[37,38]. 이러한 상충 관계를 극복하기 위해서는 나노 복합체 도입이나 비공유 초분자 결합 방식을 활용한 혁신적인 접근 방식의 연구가 필요하다. 특히, 바이오 전자소자는 소재의 유연성과 내구성뿐만 아니라 장기적인 안정성까지 요구하므로, 이를 충족시키기 위한 재료 설계가 필수적이다. 따라서, 앞으로는 낮은 Tg를 가지면서도 유연하고 내구성이 보장된 재료에 대한 연구가 이루어져야 하며, 이를 통해 자가치유 고분자는 바이오 전자소자에서의 응용 가능성을 높일 수 있을 것이다. 마지막으로, 향후 바이오 전자소자 시스템은 단순한 신호 측정과 전달을 넘어 실시간으로 기기의 반응을 제어하는 완성도 있는 폐회로 시스템으로 발전해야 한다. 이러한 시스템은 특히 신경 질환 및 심혈관 질환과 같은 복잡한 생체 질병을 환자의 반응에 맞추어 실시간으로 상태를 모니터링하고 조절할 수 있는 가능성을 열어준다. 이미 높은 성능을 보이고 있는 실리콘 기반의 전자 시스템에 비해 아직 초기단계 수준의 바이오 접착성, 자가치유, 폐회로 시스템 기술의 발전은 향후 바이오 전자소자 기술의 주요 이정표가 될 것이다. 생체 조직과의 장기적 호환성을 보장하는 동시에, 신체에 가하는 부담을 최소화하는 이러한 기술들은 미래의 의료 기기 및 환자맞춤 헬스케어의 중요한 기초가 될 것이며 인간의 삶의 질을 향상시킬 것으로 기대된다.