1. 서론
심박수, 혈압, 산소포화도 등 심혈관 건강에 대한 지속적인 모니터링은 심혈관 질환을 발견하기 위한 중요한 측면으로 인식되고 있다. 웨어러블 헬스케어 기기는 일상생활에서 24시간 신체 상태의 변화를 확인할 수 있기에 스마트 워치, 스마트 링 등 웨어러블 헬스케어 산업은 수십 년 동안 빠르게 성장했다[1-3]. 이 기간동안 심박수, 혈압, 심전도뿐 아니라 심박수 변이도(heart rate variability, HRV), 포도당 수치, 수면 패턴까지 분석할 수 있는 웨어러블 헬스케어 기기가 등장했다[4-6]. 특히, HRV는 스트레스 수준, 정신적 건강, 수면의 질 등을 판단하기 위한 중요한 요소로 사용된다[7,8].
이러한 심혈관 관련 정보를 취득하는 여러 생체 신호 센서들은 보통 손목, 팔목 등에 압박대를 감아 압력을 인가시키는 방식, 혹은 전압을 인가하는 센서들을 피부 표면에 부착하여 심장박동에 따른 전기 신호의 전위차를 파악하는 방식(electrocardiogram, ECG) 센서) 등으로 측정을 진행하게 된다[9,10]. 이럴 경우, 측정 대상자의 움직임을 제한하게 될 뿐만 아니라 피부 표면의 이물질 등으로 인한 측정 오차가 발생할 수 있는 문제가 있다[11]. 그러나 이와 달리 광혈류 측정 센서(photoplethy-smography, PPG)는 다음과 같은 몇 가지 이점이 있어 가장 대중적으로 사용된다. 첫째, PPG 센서는 빛을 이용한 비접촉식 측정 장치로, 피부 표면의 습기 및 먼지로 인한 센서-피부 간 접촉 저항 문제로부터 자유롭다[12]. 둘째, ECG 센서와 달리 신체에 전기적인 자극을 주지 않기 때문에 센서 동작으로 인한 신체 영향을 최소화할 수 있다[13]. 셋째, PPG 센서는 광원과 광검출기만 필요하기에 다수의 전극 및 큰 장치가 필요한 다른 센서에 비해 웨어러블 기기와의 통합용이성이 우수하며, 일상생활에 불편함 없이 사용하기 적합하다.
그러나 기존의 PPG 센서는 주로 견고한 무기물로 구성되었다. 이러한 재료는 높은 기능적 능력에도 불구하고 특히 유연성, 편리성 및 생체 적합성 측면에서 상당한 한계를 나타낸다. 무기 물질의 강성은 피부에 기계적 스트레스를 유발하여 잠재적으로 불편함을 유발하고 장기간에 걸쳐 장치의 착용성을 감소시킬 가능성이 존재한다.
이러한 한계를 극복하기 위해 신축성을 가진 유연 PPG 센서 개발에 대한 관심이 높아지고 있다. 실리콘(silicon, Si) 혹은 갈륨 아스나이드(gallium arsenide, GaAs) 등의 기판에서 생성되는 다른 소자와 달리, 유연 소자는 고분자 기반의 유연성을 가지고 있는 소재를 기판으로 하여 그 위에 소자를 형성하는 방식으로 제조된다[14]. 이러한 유연 소자는 피부의 굴곡 혹은 부착 위치에 따른 제약을 받지 않고 PPG 신호를 추출할 수 있다. 처음 유연 PPG 제작에서는 무기물 기반으로 제작된 연성이 없는 소재를 활성층으로 하여 기판만 유연한 소재로 제작한 연구들이 대다수였으나, 점차 높은 연성의 활성층 소재 및 구조의 제작을 통한 고연성 PPG 센서에 대한 연구가 진행 중이다. 본 논문에서는 활성층을 구성하는 재료의 변화에 따른 현재까지의 유연 PPG 센서 연구 동향과 향후 유연 PPG 센서의 연구 방향에 대해 설명하고자 한다.
2. PPG 센서 동작 메커니즘
우선 PPG 분석의 기본 메커니즘은 다음과 같다[15]. PPG는 혈관에서 맥동하는 혈류에 의해 흡수되거나 반사되는 빛을 이용하여 심혈관 정보를 습득 및 분석한다. 신체의 대사 과정에서 혈관의 부피는 심장의 이완과 수축을 통해 변하며, 이로 인해 혈관에 흡수되는 빛의 양은 심장 상태 변화에 따라 달라진다. 이와 같은 혈류량 및 혈관의 부피 변화를 분석하는 것에는 투과되는 빛의 양을 판별하는지, 혹은 혈관으로부터 반사되는 빛의 양을 분석하는지에 따라 그 방식이 달라진다. Fig. 1(a)와 같이 transmission mode (TM-mode)와 reflection mode (RM-mode)의 두 가지 주요 모드가 있다. TM-mode에서는 light-emitting diode (LED)와 photodetector (PD)를 조직의 반대편에 배치하고 신체 부위를 투과한 빛을 심혈관 분석에 사용한다. 이러한 유형의 센서는 LED가 PD와 명확하게 분리되어 있어 빛의 간섭이 적다는 이점이 있으나, 측정 시 손가락으로 누르는 등 과도한 압력이 가해질 경우 주변 혈액량을 감소시켜 추출 신호의 왜곡을 초래할 수 있다. 반면 RM-mode는 PD가 반사된 빛을 포착하기 위해 광원과 같은 면에 위치한다. TM-mode와 달리 광원과 센서가 마주 보고 있지 않아도 되기에 신체 부위의 다양한 부위에 적용할 수 있다는 큰 이점이 있다. 그러나 광원이 센서 바로 옆에 있기 때문에 광원으로 인한 빛의 간섭을 겪을 수 있으며, 각 모드에는 장단점이 있으므로 모드 선택에 따라 측정 환경과 적용 목적에 대해 심각하게 고려해야 한다.
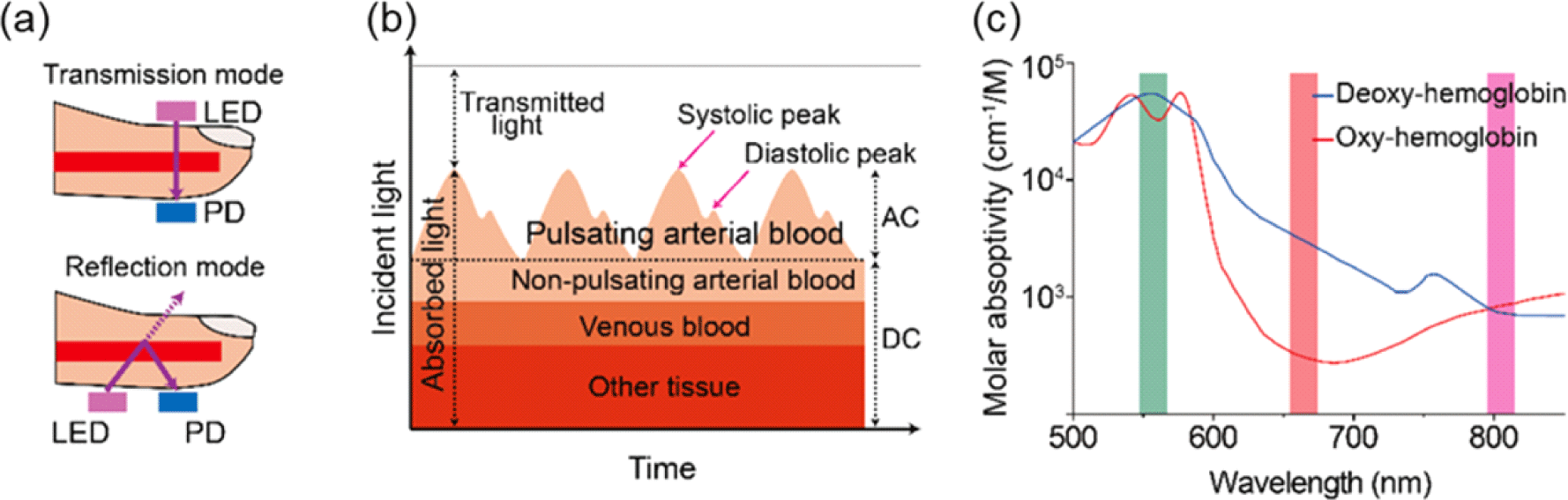
다음으로, 추출된 신호는 Fig. 1(b)와 같은 개형으로 추출된다. 해당 그림을 살펴보면 direct current (DC) 부분과 alternating current (AC) 부분이 분리되어 있는데, DC 부분은 조직, 정맥혈, 비박동 동맥혈과 같은 일부 비박동 부분에 의해 형성되기에 혈류량의 변화와 무관하다. 우리가 고려해야 할 사항은 맥동하는 동맥혈로 형성되는 AC 부분이며, 이 부분은 실제 심혈관 맥박을 의미한다. 정확하게 추출된 맥박에는 수축기 피크(systolic peak)와 이완기 피크(diastolic peak)가 존재한다. 수축기 피크는 심장이 수축하여 동맥혈관으로 혈액을 보낼 때 발생하며, PPG 파형의 첫 번째 부분을 구성하는 혈압이 가장 높은 순간이다. 반면에 이완기 피크는 심장이 이완하게 되면서 확장하는 순간 혈관에서 유지되는 압력을 의미하며, 혈압이 가장 낮은 순간을 의미한다. 이렇듯 수축기/이완기 피크의 형성 여부, AC 부분 신호의 주기 등을 통해서 혈압 및 심박수와 같은 정보를 얻을 수 있다.
기본적인 심혈관 정보 파악 이외에, PPG 센서의 독특한 특징 중 하나는 혈중 산소 포화도 측정이 가능하다는 점이다. 산소를 보유하지 않고 있는 헤모글로빈인 디옥시 헤모글로빈과 산소를 보유하고 있는 옥시 헤모글로빈의 파장에 따른 몰 흡수율은 Fig. 1(c)에 나온 것과 같이 입사 파장에 따라 그 정도가 다르다. 두 헤모글로빈 모두 녹색 파장과 근적외선 파장에서의 흡수율이 유사한 반면, 적색 파장에서는 그 수치가 서로 매우 상이하다는 것을 확인할 수 있다. 이를 이용해 서로 다른 파장의 빛을 추출하여 식 (1)을 이용해 혈중 산소 포화도를 측정한다.
여기서 CHbo2 와 CHb는 각각 옥시 헤모글로빈과 디옥시 헤모글로빈의 포화도를 나타낸다. 이처럼 광혈류측정기법은 기존과 색다른 생체 정보 파악에 용이하다.
3. 피부 부착형 유연 PPG 센서의 최근 연구 동향
위에서 언급했듯, PPG 센서는 타 심박 센서와 달리 비접촉식 측정, 혈중 산소포화도 측정 등의 장점을 가지고 있다. 그러나 다른 심박 센서들과 마찬가지로 PPG 센서 역시 측정 대상자의 움직임, 측정 부위와 센서 간의 유격 등으로 인한 신호 추출 오류 문제가 주요 한계점으로 알려져 있다. 이를 극복하기 위해 대상자의 움직임 속에서도 정확하게 신호 추출이 가능한 피부 부착형 유연 PPG 센서와 관련된 연구가 활발하게 진행되고 있다. 본 논문에서는 제작된 소자의 소재에 따라 각 센서의 종류에 대해 소개하고, 이를 통해 각 센서별 장단점에 대해 소개하고자 한다.
무기 소자의 장점은 기존에 상용화된 공정 기술을 바탕으로 구성된 소형 소자 및 회로 제작 기술을 그대로 응용하여 유연 센서를 구현할 수 있다는 점이다. 현재 무기물 기반 흡광 다이오드로 사용되고 있는 대표적인 2가지 재료로는 Si과 GaAs가 있다. 먼저 Si 포토 다이오드는 ultraviolet (UV) 범위(190 nm)에서 적외선 스펙트럼 영역(1,100 nm)에 이르기까지 넓은 파장 영역에 반응하고, 비용 효율적이며, 독성이 없는 반도체 소재이다. John.A.Rogers 연구팀이 2016년에 발표한 Near field communication (NFC) 칩 기반의 무선 통신이 가능한 초소형 웨어러블 산소포화도 측정기가 바로 그 예시 중 하나이다[16]. Fig. 2(a)에서 볼 수 있듯이, 해당 장치는 적외선 및 적색 LED와 Si P-I-N 흡광 소자로 구성되어 있으며, 증폭 회로와 자기 유도에 의한 전력 및 데이터 전송을 위한 코일로 연결되어 있다(Fig. 2(b)). 센서 내부에 부품들은 모두 60∼90 μm 너비와 5 μm 두께를 가진 뱀 형태의 신축성 전극을 시용한 신축성 있는 기판에 통합되어 있으며, 이를 통해 기존 무기소자들이 가지고 있던 기계적 변형의 취약성에 대한 한계점을 극복하였다(Fig. 2(c)). 해당 장치는 Fig. 2(d)에서와 같이 피부에 부착되어 안정적으로 생체 신호를 추출할 수 있을 뿐만 아니라 스마트폰과 2 cm 거리에서도 데이터 동기화가 가능하다. 해당 유연 센서를 이용하여 25 Hz 샘플링 속도로 데이터를 수집하여 생체 신호 데이터를 추출한 결과, 수축기 정점과 이중 맥파를 정상적으로 관찰할 수 있었다. 추출한 결과를 상업용 산소 포화도계를 이용해서 측정한 결과와 비교하였을 때도 거의 유사한 결과가 나타난 것을 확인할 수 있었다. 이를 통해 실시간 생체신호의 추출 및 확인이 가능한 플랫폼 구현이 가능하다는 것을 알 수 있다.

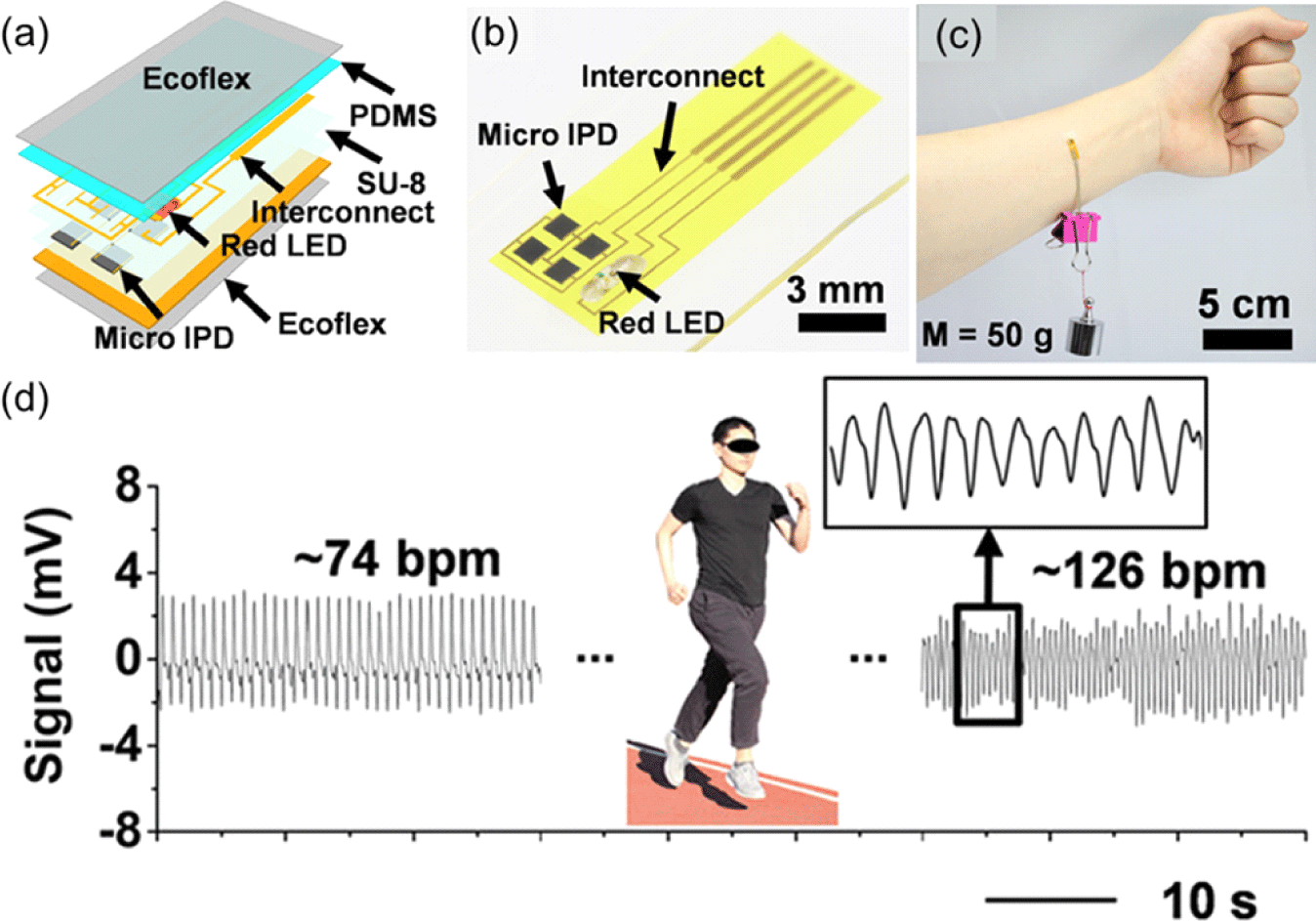
다음으로, GaAs 는 갈륨(Ga)와 비소(As)로 제작된 Ⅲ∼Ⅴ 화합물로, Si와 달리 direct bandgap 특성으로 인한 보다 효율적인 발광 및 흡광이 가능하다는 특징이 있다. 이외에도 높은 전자 이동도, 저잡은 특성 등으로 인해 Si 기반의 PPG 센서보다 좋은 효율을 보이고 있다. Kim, Juho 연구팀이 발표한 연구에서는 이러한 GaAs 소재를 사용한 무기 광다이오드(Inorganic Photodiode, IPD)와 2개의 적색 LED를Ecoflex 층 사이에 구현하여 2.4 mm 굽힘 반경 내에서 1,000번 이상의 변형에서도 안정적인 전기적 특성을 유지하며, Ecoflex 소재 특성으로 인해 피부에강한 점착성을 가지는 소자에 관하여 말하고 있다(Fig. 3(a)). 제작된 소자는 마이크로 미터 단위의 박막 형태에 interconnect 영역을 제외한 소자 부분은 약 3 mm 길이로, 부착 위치 및 부착 환경에 따른 제약 없이 측정을 진행할 수 있다 (Fig. 3(b)). 무엇보다도, Fig. 3(c)에 보이는 것처럼 50 g 무게의 추를 소자에 매달아도 Ecoflex 자체의 점착성으로 인해 소자가 떨어지지 않고 피부 위에 안정적으로 부착될 수있다. 이를 통해 소자를 부착한 상태로 움직이는 상태에서도 측정을 진행할 수 있으며, 실제로 해당 소자를 통하여 심박수를 추출하였을 때, 운동 이전에 추출된 심박수(74 bpm)보다 상승한 심박수(126 bpm)를 추출하는 것에 성공하였다(Fig. 3(d)). 이를 통해 해당 논문에서 개발된 무기 소자가 안정적으로 피부 위에 부착되어 실시간으로 생체 신호를 추출할 수 있다는 것을 확인할 수 있다.
발광 소자 측면에서는 다중양자 우물(multi-quantum well, MQW) 구조의 소자를 PPG 측정에 활용하는 시도가 선보이고 있다. 해당 소자는 높은 발광 효율과 함께 박막 형태의 소자 구현이 가능하다는 장점이 있다. 이를 통해 기존 무기물의 낮은 연성 문제를 해결함과 동시에, 높은 발광 효율을 저전력 형태로 장시간 구현이 가능하다는 장점을 가지고 있다. 보통 이러한 micro-LED 들은 Ⅲ∼Ⅴ 화합물 결합 조성비 조절을 통해 발광 스펙트럼을 조정하며, 청색/녹색 영역에서는 GaN 기반의 활성층이, 적색/근적외선 영역에서는 AlGaAs, AlGaInP 등의 활성층들이 활용된다.
C.Pan 연구팀이 발표한 연구에서는 이러한 GaN 기반의 MQW LED-PD 통합형 광전자 칩을 활용해 RM-mode PPG 센서를 개발하였다. 해당 소자는 4인치 GaN 사파이어 LED epitaxial 웨이퍼를 기반으로 제작되었으며, 제작과정은 Fig. 4(a)에 자세히 묘사되어 있다[18]. 먼저, (1) ITO를 증착한 후 질소 분위기에서 급속 열처리를 진행한 후, ICP-RIE(inductively coupled plasma reactive ion etching) 식각을 통해 (2)와 같은 메사 구조를 형성한 이후 N-doped GaN 층까지 ITO를 식각하였다. 이후 한 번 더 ICP-RIE 공정을 진행해 (3)과 같은 형태를 제작하였으며, 이후 Ni/Al/ Ti/Al 금속층을 증착하여 p-전극을 형성하고, SiO2절연층을 형성하였다. 이후 최종적으로 형성된 센서의 모양은 (6)과 같으며, 가운데 LED와 LED를 둘러싼 PD 그리고 그 주위에 LED/PD의 양극과 음극이 형성되어 있는 것을 확인할 수 있다. 통합된 칩은 이후 유연 인쇄 회로 기판에 flip-chip bonding된 후 PDMS encapsulation layer 증착을 통해 기계적 변형에 대한 내구성과 피부 친화적 특성을 높였다. 이후 손가락 위(Fig. 4(b))와 손목 위(Fig. 4(c))에서의 PPG를 분석하였다. 이 과정에 청색과 녹색 LED로 통합된 소자 간의 성능을 비교 분석한 결과, LED와 PD의 발광-흡광 스펙트럼이 더 많이 겹치는 청색 LED로 제작된 통합 센서가 더 높은 효율을 보이는 것을 확인하였다. 또한, PPG 신호는 손가락 끝에서 더 높은 진폭을 보이는 것을 확인하였으며, 이를 통해 반사형 PPG 센서의 성능 최적화를 위해서는 측정 위치를 고려해야 한다는 것을 알 수 있다.
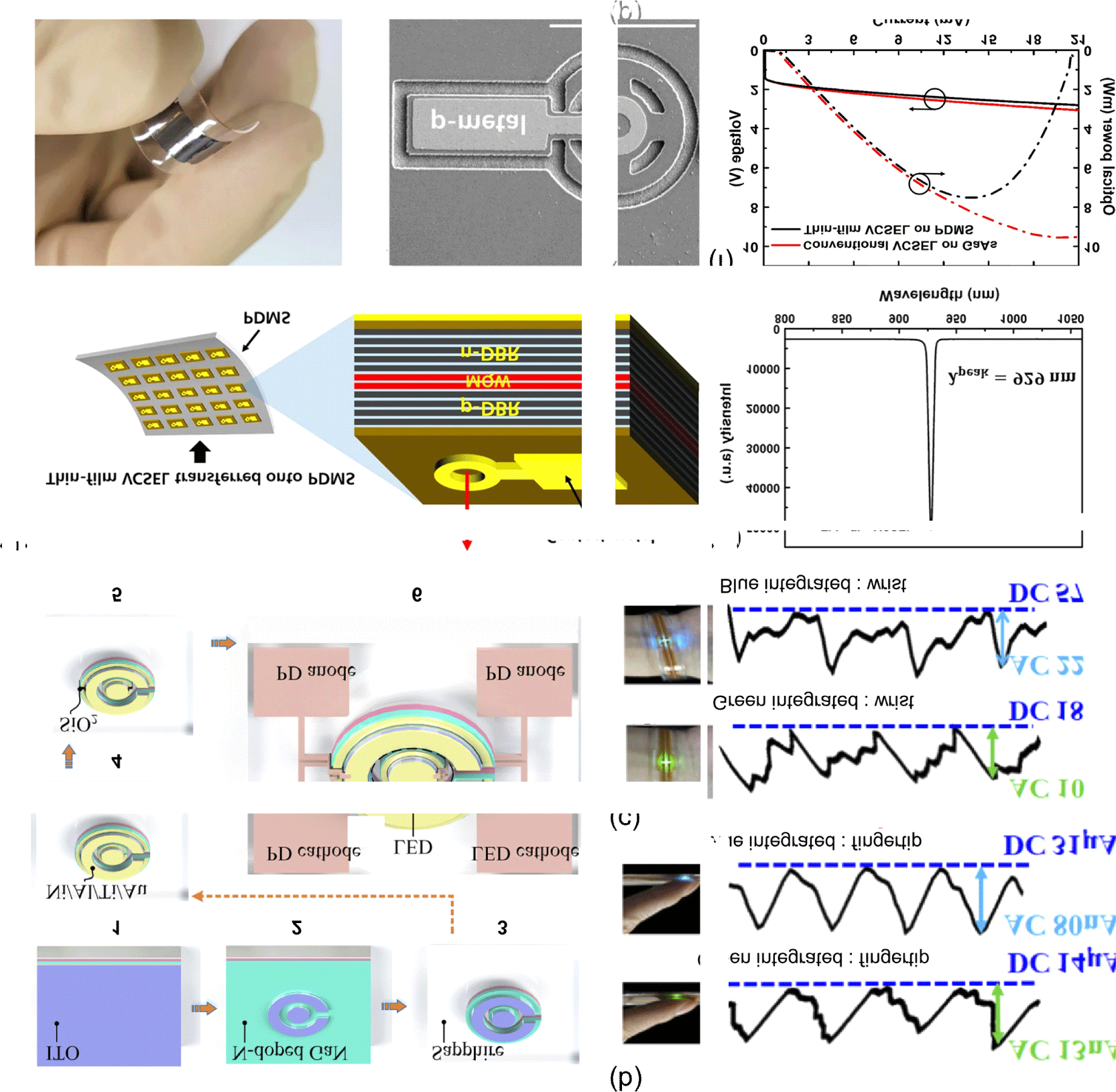
다음으로, LED보다 높은 발광 효율을 나타내는 수직 캐비티 표면 광방출 레이저(vertical-cavity surface-emitting laser, VCSEL)을 개발하여 이를 바이오 소자로써 활용하고자 하는 시도가 있었다. J. Lee 연구진은 AlGaAs 기반의 MQW VCSEL 소자를 PDSM 위에 제작하여 유연한 VCSEL 어레이를 구성하는 것에 성공하였다[19]. 해당 소자는 MOCVD 공정을 통해 성장된 VCSEL 구조를 총 2번의 전사과정을 거쳐 PDMS 위에 부착하였다. PDMS 위에 VCSEL을 전사하는 과정은 다음과 같다. 먼저, VCSEL 구조의 상단부를 보호하기 위해 사파이어 캐리어를 준비하고 Apiezon W 왁스를 사용하여 VCSEL의 상단부를 사파이어 캐리어에 부착한다. 이 과정은 약 150℃로 가열된 상태에서 진행되며, VCSEL의 상단부를 손상으로부터 보호한다. 이후 NH4OH 기반의 식각액을 사용하여 GaAs 기판을 제거하고, 에치 스톱층이 드러난다. 드러난 에치 스톱층은 HCl 용액을 사용해 제거된다. 이후, VCSEL을 PDMS 기판 위로 전사하기 위한 준비로 PDMS 기판을 산소 플라즈마 처리하여 표면을 친수성으로 변환한다. 동시에 실란(APTES) 처리를 통해 PDMS와 VCSEL 간의 결합력을 강화한다. 다음으로, 산소 플라즈마 및 실란 처리가 완료된 PDMS 기판 위에 VCSEL 구조를 결합한다. 이 과정에서 롤러를 사용하여 균일하게 결합되도록 처리하며, 추가적인 결합 장비는 필요하지 않다. 마지막으로, TCE 용액을 사용하여 사파이어 캐리어를 제거함으로써 VCSEL의 전사 공정을 마무리한다. 이러한 과정을 거쳐 제작된 소자는 그림 Fig. 4(d)에서 볼 수 있듯이 높은 유연성과 구조 해상도를 가지는 것을 확인할 수 있다. 해당 VCSEL의 장점은 오직 929 nm의 근적외선 영역만 흡광이 가능하다는 것인데, 이를 통해 외부 입사광의 방해에 강한 PPG 센서 제작에 응용될 수 있다(Fig. 4(e)). PDMS 전사 이전과 이후의 성능을 서로 비교 분석한 결과, PDMS 위에 VCSEL을 전사했을 때에도 기존 VCSEL 성능을 유지하는 것을 확인하였다(Fig. 4(f)). 결론적으로, 본 연구는 생체친화성과 유연성 부분에서 무기물 소자가 가지는 한계를 극복하였다.
이렇듯, 무기물 기반 PPG 센서들은 용이한 제작과 더불어 기존에 사용되던 기술 기반으로 기판만 단순하게 교체하여 제작 가능하다는 장점이 있다. 그러나 무기 소재의 특성상 소자의 유연성을 증가시키기에는 분명한 한계점이 존재한다는 점, 소재의 비싼 가격, 그리고 지속적으로 피부에 부착하면 신체에 무리를 줄 수 있는 등의 문제점을 가지고 있다.
앞서 언급한 무기소재의 한계점을 극복할 수 있는 소재가 바로 페로브스카이트 구조 기반 소자이다. 페로브스카이트는 금속, 유기물, 할로겐족 물질 등이 결합되어 화합물결정구조를 형성한 물질로서 높은 광흡수성, 우수한 전하 이동도를 가진다는 것이 장점 중 하나이다. 또한, 소재 가격이 무기 소재보다 저렴하며, 용액공정 기반의 대면적 소자 제작에 용이하다. 무엇보다도 무기 소재 대비 가벼운 무게와 높은 유연성을 지니기에 피부 부착형 센서를 만들기에 적합하다.
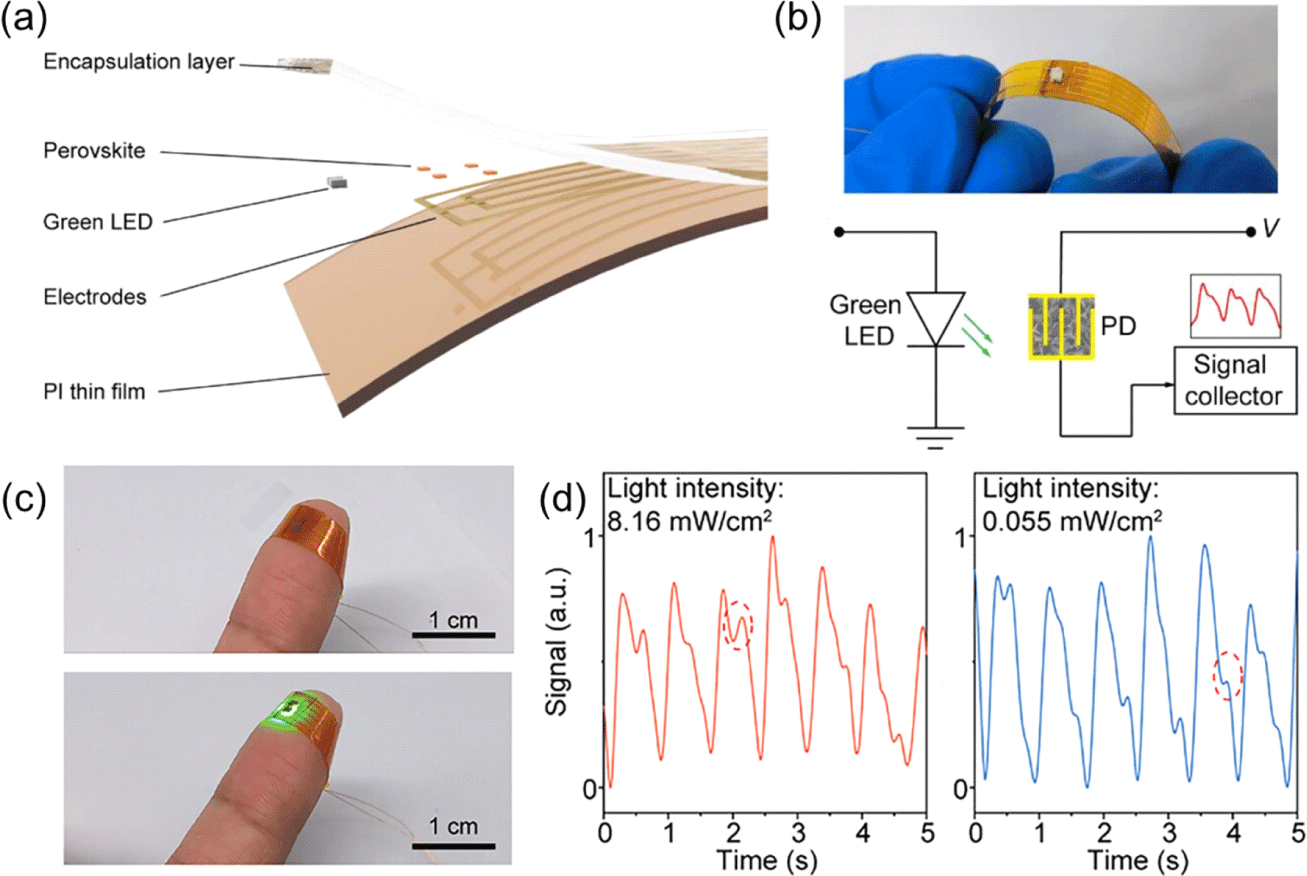
이러한 장점들을 기반으로, 피부의 곡률에 따라 대면적으로 부착하여 PPG 신호를 추출할 수 있는 센서들이 등장하였다. S. Hwang 연구진은 녹색 파장의 LED와 perovskite 기반의 광다이오드를 polyimide(PI) 기판 위에 형성한 perovskite 기반의 유연 PPG 센서를 구현하였다(Fig. 5(a))[20]. 해당 소자는 표면 에너지 기반의 증기 증착 패터닝 방법(selective area pulsed vapor deposition, SEAPVD)을 이용해 Fig. 5(b)에서 보이는 것과 같이 신축성 있는 무기 페로브스카이트 소자를 제작하였다. 이를 통해 표면 에너지를 조절하여 특정 위치에 고해상도 페로브스카이트 증착을 유도했다. 이와 같이 제작된 소자는 13,887의 높은 on/off 비율과 47.5 A/W의 높은 반응성을 보여 뛰어난 광전자 성능을 가진 것을 확인하였다. 또한, encapsulation layer를 통해 높은 습도 환경에서도 12시간 동안 안정성을 유지하며 12시간 착용 후에도 피부 위에 부착되어 안정적인 펄스 신호를 감지하는 피부 부착형 PPG 센서로 활용되는 것 역시 확인할 수 있다(Fig. 5(c)). 해당 센서를 통한 PPG 신호 측정 결과를 확인하였을 때, 소자의 높은 반응성을 기반으로 낮은 조명 조건(0.055 mW/cm2)에서도 높은 조명 조건과 유사하게 신호를 감지할 수 있으며, 신뢰성 있는 장기적인 건강 모니터링에 적합한 잠재력을 가지고 있는 것을 확인할 수 있다(Fig. 5(d)).
다음으로, 보다 더 높은 소자 효율을 만들기 위하여 도입된 개념이 페로브스카이트 quantum dot(QD) 소자이다. 페로브스카이트 QD 소자는 소자가 특정 양자 에너지만을 보유 가능하게끔 만들어 흡광 및 발광 과정에서의 손실을 최소화할 수 있다는 장점이 있다. 또한, 기존의 페로브스카이트 기반 발광 소자의 낮은 효율과 안정성 문제를 해결할 수 있다는 점에서 흡광 소자뿐만 아니라 발광 소자를 제작하는데 있어서도 큰 도움을 준다. 이러한 장점을 가지는 QD 소자에 신축성을 부여하여 유연 PPG 센서를 제작하기도 하는데, 그 중에서 I. Pan, 연구진은 QD-LED와 QD-PD의 제작 시에 주름 구조가 형성된 기판 위에 소자를 제작하는 방법을 사용했다[21]. Fig. 6(a)에는 해당 논문에서 제작한 QD-LED 전체 구성물질과 해당 소자에 주름 구조를 추가하는 과정을 보여주고 있다. 1.3 μm 두께의 PEN (polyethylene naphthalate) 기판 위에 그래핀을 전사하고 그 위에 활성층을 형성한다. 이후, 전사 프린팅 방식으로 미리 좌우로 늘어져 있는 탄성 기판
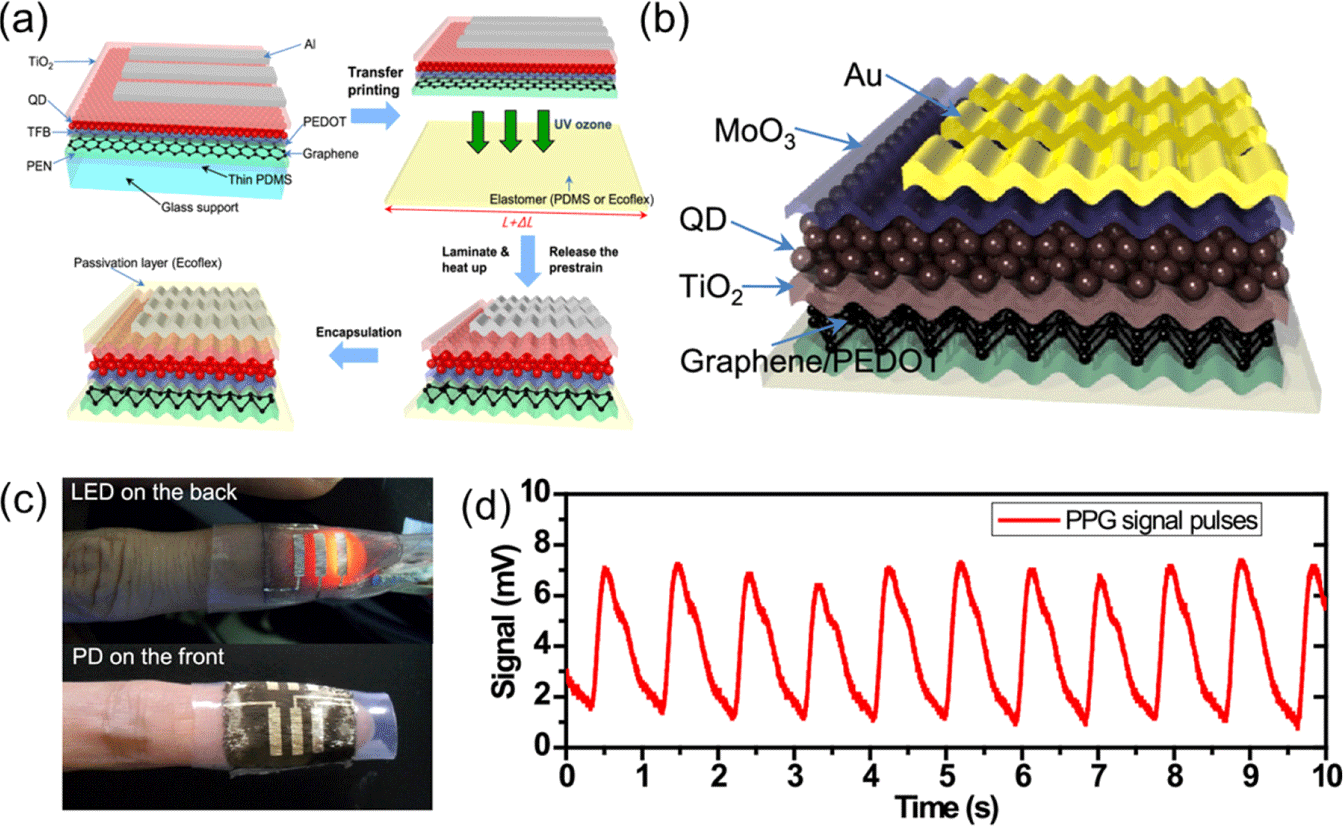
위에 옮긴 후, 사전 변형된 기판이 완화되면서 자연스럽게 물결 모양의 구조를 소자에 형성하여 소자로 하여금 높은 신축성을 지니게 된다. 이로 인해 본 논문의 QD-LED는 준수한 색 순도를 유지하면서 70%까지 늘어날 수 있다. 마찬가지 방식으로 QD-LED를 Fig. 6(b)에 보이는 것처럼 제작하였으며, QD-PD 도 마찬가지로 70% 정도까지 연신 가능하다. 이와 같이 제작된 QD 소자들을 Fig. 6(c)에 보이는 것과 같이 손가락에 부착하여 PPG 신호를 추출하였으며, 그 결과 안정적인 레벨을 유지하며 수축기/이완기 피크가 명확하게 드러난 PPG 신호가 추출되는 것을 확인할 수 있었다 (Fig. 6(d)).
유기 소재 기반의 PPG 센서는 본질적으로 높은 유연성, 저비용 제조 및 가볍다는 장점이 있어 피부 부착형 PPG 센서로서 많은 주목을 받았다. 또한, 유기 소재 자체의 고유연성 덕분에 유기 기반의 PPG 센서는 높은 피부 적합성을 보인다. 이러한 특성으로 인해 유기 소재 기반 PPG 센서들은 피부 굴곡에 정확히 부착되며, 다른 유연 PPG 센서들과 달리 센서와 피부 간 유격 발생 혹은 부분적인 센서의 이탈로 인해 발생하는 신호 왜곡 현상, 즉 motion artifact (MA) 현상이 현저히 적게 나타날 수 있다.
그럼에도 불구하고, 여전히 측정 대상의 움직임으로 인한 MA가 존재하기 때문에 이 부분을 해결하는 것이 중요한 문제이다. 때문에, 정확한 생체 신호의 추출을 위해서 신호 필터를 활용하거나 알고리즘을 활용하여 움직임에 따른 신호 변화를 파악하여 신호를 보정하는 등의 연구가 진행되고 있다[22,23]. 그러나 이러한 방법들은 별도의 신호 처리가 필요하다는 단점이 존재하기 때문에, G. H. Lee 연구팀은 orthogonal polarizer-analyzer (OPA)라는 편광판을 사용하여 인체의 움직임에도 높은 품질의 신호를 별도의 신호처리 과정 없이 검출하는 organic light-emitting diode (OLED)-organic photodetector (OPD) 통합 센서에 대해 보고하였다[24]. Fig. 7(a)에서는 인체의 움직임에 따른 피부 조직 내에서의 빛의 산란을 보여주며, Fig. 7(b)는 개발된 OLED-OPD 통합 센서의 구조를 보여준다. 연구팀은 OPA를 통해 인체의 움직임에 의해 발생하는 산란 빛의 변화가 OPD에 영향을 미치지 않도록 설계하였다. 연구팀이 개발한 PPG 센서를 손목에 부착한 후 손목의 각도를 ±10°로 구부리고 접었을 때의 PPG 신호를 확인하였으며, OPA를 사용할 시 움직임에 의한 MA의 영향을 90% 이상 줄였다(Fig. 7(c)). 결과적으로, 제안된 피부 부착형 PPG 센서는 추가적인 filter나 알고리즘 없이 OPA를 활용하여 MA를 효과적으로 제거할 수 있음을 입증했다.
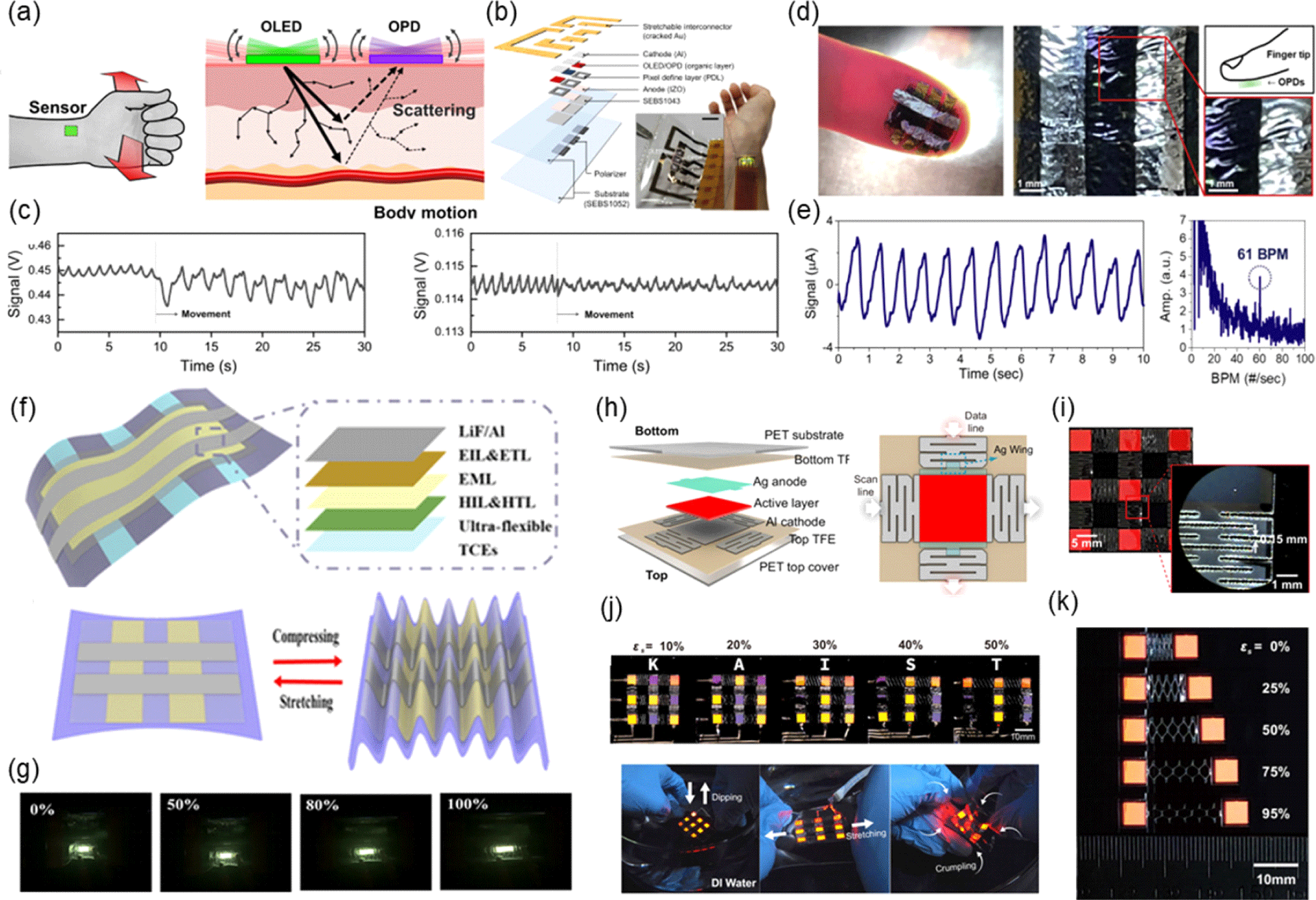
한편, MA를 해결하기 위한 근본적인 문제는 결국 대상의 움직임에도 소자가 완전히 부착되어 있는 것이 중요하기에, 최근에는 피부 위 지문이나 주름 등에 완전히 부착되는 수축 및 이완 반복이 가능한 소자를 만드는 것에 관심이 높아졌다. 이에 따라 본 연구진과 아주대학교 김종현 교수로 구성된 공동 연구팀은 피부의 미세 굴곡에서도 높은 부착성을 갖기 위해 고분자 유연 기판인 parylene을 사용하여 3 μm 이하의 매우 낮은 두께를 갖는 초유연 근적외선 PPG 센서를 개발하였다[25]. 해당 논문에서는 센서의 근적외선 흡수율을 시키기 위해 적색 파장에서 높은 흡수율을 보이는 donor PTB7-Th와 근적외선 영역에서 높은 흡수율을 보이는 acceptor Y6를 혼합한 활성층으로 사용하여 총 두께 3 μm 이하의 초박막형 유연 소자를 제작하였다. 그 결과, 해당 센서는 800 nm 파장 및 −0.5 V 전압 하에서 2.2×1012 Jones의 높은 검출도를 보였다. 또한, PPG 센서의 온도, 습도 및 기계적 안정성 테스트를 진행한 결과, 110℃의 고온 및 50%의 relative humidity (RH) 환경에서도 안정적으로 구동 가능하다는 것을 확인할 수 있었다. 또한, 기계적 안정성을 확인한 결과, 기존 소자 상태 대비 66%의 압축 변형에도 초기와 비슷한 수준의 성능을 유지하였다. 연구팀은 이러한 높은 안정성을 보이는 PPG 센서를 손가락에 부착하여 전송 모드에서 PPG 신호 검출을 시연하였다. 그 결과, 부착 시 지문이 보일 정도의 높은 피부 적합성을 가졌으며(Fig. 7(d)), 851 nm의 근적외선 환경에서 신뢰성 있는 PPG 신호를 검출하였다(Fig. 7(e)). 이렇듯 피부 굴곡에 따라 완벽히 부착할 수 있는 초유연 유기 PPG 센서의 등장은 초경량 소자를 기반으로 인체에 무해한 정확한 신호 추출이 가능하게끔 하는 밑바탕을 형성하였다.
높은 유연성을 확보하기 위한 연구는 센서뿐 아니라 광원에서도 활발히 진행되어 왔다. W.Y. Lai 연구진은 기존의 OLED 분야에서 대중적으로 사용되던 indium tin oxide(ITO)의 복잡한 공정 및 낮은 유연성 문제를 해결하고자 초유연 투명 복합 전극을 개발하였다[26]. 연구팀은 공정 복잡성을 줄이기 위해, blade-coating, inkjet printing 기법을 사용하였으며, 85% 이상의 투과율 및 7 Ω/□ 정도의 높은 전도성을 갖는 초유연 투명 전극을 개발하였다. 개발된 초유연 투명 복합 전극은 2,000번의 굽힘에도 95% 이상의 초기 전도도를 유지하였다. 연구팀은 개발한 초유연 투명 전극을 활용한 OLED를 구현하였으며(Fig. 7(f)), 구현된 OLED는 기존 ITO 기반의 OLED보다 1.2배 높은 전류 효율을 보였다. 이후 진행된 2,000번의 굽힘 실험에서도 초유연 투명 전극이 사용된 OLED는 기존 대비 83%의 밝기를 유지하였다(Fig. 7(g)).
연구자들은 새로운 유연성 소재를 개발하는 대신, 구조적 접근을 통해 기계적 안정성이 높은 OLED의 구현을 위해서도 노력해 왔다. K. C. Choi 연구팀에서는 kirigami 구조의 전극과 island-interconnection 구조를 활용하여 95%의 신축에도 뛰어난 내구성을 갖는 신축성 OLED를 개발하였다(Fig. 7(h))[27]. Fig. 7(i)에서는 개발된 kirigami interconnection 구조신축성 OLED의 실제 소자 이미지를 보여준다. 해당 연구팀은 기존 kirigami 구조의 문제인 공정 복잡성을 줄이고자 레이저 절단 공정을 도입하였으며, 장기간 동작을 위한 thin film encapsulation(TFE) 층을 적용했다. 높은 유연성을 보장하는 kirigami interconnection 구조 덕분에, 개발된 OLED는 95%의 연신과 100,000번의 50% 연신에도 안정적인 휘도 특성을 유지하였으며(Fig. 7(j)), dipping, stretching, crumpling 등의 외부 자극에도 안정적인 동작을 보였다(Fig. 7(k)). 이러한 간편한 레이저 패터닝과 구조적 접근을 통한 인체 적합형 신축성 디스플레이의 구현은 향후 유연하고 내구성이 뛰어난 차세대 전자 장치의 상용화를 가속화할 것으로 기대된다.
앞서 소개한 소재들 이외에도 높은 광전도와 낮은 전력소모로 장점이 많은 2차원 소재인 graphene 기반의 PPG 센서[28,29] 외 무기물의 높은 성능과 유기물의 생체친화성을 동시에 활용 가능한 IGZO/DPP 등의 유무기 하이브리드 합성 물질 기반의 PPG 센서[30] 관련 연구 역시 보고되고 있다. 해당 기술들은 높은 유연성을 바탕으로 PPG 적용 가능성에 대한 여부가 검증이 되었으나, 제조공정 단순화 및 소자의 고성능화를 위한 추가 개발이 요구된다.
4. 결론 및 전망
본 논문에서는 다양한 종류의 소재 기반 피부 부착형 유연 PPG 센서에 대한 최근 연구 동향에 대해 논의하였다. 주로 장시간 건강 모니터링을 위한 잡음 개선, 신호 증폭 및 높은 피부 부착성을 위한 전략들이 제시되었다. 하지만, 이러한 피부 부착형 PPG 센서의 상용화를 위해서 해결해야 할 몇 가지 문제가 존재한다. 먼저, 피부 부착 시에도 정확하고 안정적인 PPG 신호를 감지하는 것은 가장 중요한 사항으로 여겨진다. 때문에, 외부에서 발생하는 잡음(인체 움직임, 외부 광, 외부 전파 잡음 등) 및 장시간 부착으로 인해 발생하는 습기나 땀에 의해 발생하는 잡음을 제거하고 높은 정확성을 위한 알고리즘의 개발이 필요하다. 소자 측면에서는 탈부착이 가능하며 장시간 피부에 붙어있어도 피로도가 적으며 높은 피부 접착성과 통기성을 가지는 소재를 활용한 연구가 필요하다. 또한, 보다 얇고 높은 출력 신호를 내기 위한 신규 발광 및 흡광 소재에 관련하여 지속적으로 연구를 진행하고, 이를 통해 고감도 PPG 센서를 개발하는 연구가 필요하다. 마지막으로 혈류량 및 용존 산소 포화도만을 측정하는 현재 PPG 센싱 범위의 한계를 벗어날 필요가 있다. 헤모글로빈이 가지고 있는 물질에 따라 헤모글로빈의 파장 흡수 범위가 변하게 되는데, 이를 통해서 당뇨, 빈혈증 등 다양한 질병을 관찰할 수 있는 센서로써 발전이 이루어져야 한다[15]. 이외에도 낮은 전력 소비, 소형화, 경량화 및 고성능화에 대한 연구와 발전이 위에서 언급한 문제 해결과 병행될 경우, 피부 부착형 유연 PPG 센서는 장시간, 실시간으로 질병관리가 필요한 의료 건강 모니터링 분야에 대중적으로 사용될 것이라 기대된다.












